题目内容
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。 回答下列问题:
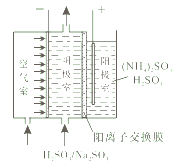
(1)阴阳极同步产生过氧化氢和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极发生氧化反应的离子是_______,阴极的电极反应式为_________。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% | |
无 | — | 2 | Fe3+ | 1.0 | 15 | |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 | |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为________(填标号)。
A 纯铝 B 黄铜 C 铸铁 D 不锈钢
(3)在弱碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=OH(aq)+Mn3+(aq)+OH-(aq) ΔH=a kJ/mol
H2O2(aq)+Mn3+(aq)+2OH-(aq)=Mn2+(aq)+·O2- (aq)+2H2O(l) Δ=b kJ/mol
OH(aq)+·O2-(aq)=O2(g)+OH-(aq) ΔH=c kJ/mol
则2H2O2(aq)=2H2O(l)+O2(g)的ΔH=_________,该反应的催化剂为________。
(4)298 K时,将10 mL a mol·L1 NaH2PO2、10 mL 2a mol·L1 H2O2溶液和10 mL NaOH溶液混合,发生反应:H2PO2-(aq)+2H2O2(aq)+2OH(aq)![]() PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
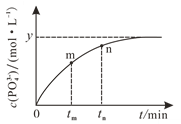
①下列可判断反应达到平衡的是_______(填标号)。
a c(H2PO2-)=y mol·L1
b 溶液的pH不再变化
c v(H2O2)=2v(H2PO2-)
d c(PO43-)/c(H2PO2-)不再变化
②tm时v逆_____tn时v逆(填“大于”“小于”或“等于”)。
③若平衡时溶液的pH=12,则该反应的平衡常数K为___________。
【答案】SO42- O2+2H++2e-=H2O2 Cr3+ A (a+b+c)kJ·mol-1 Mn2+ b d 小于  (L/mol)4
(L/mol)4
【解析】
(1)电解池阳极发生氧化反应,阳极发生反应的是溶液里的阴离子,阴极发生还原反应;
(2)由表中数据分析,加入量少且使双氧水分解率大的离子就是能使过氧化氢分解反应活化能降低最多的离子,贮运过氧化氢时,可选用的容器材质不能促进双氧水分解;
(3)根据盖斯定律进行分析解答;
(4)①可逆反应达到平衡的判断就是变化的量不变了,②根据反应处于平衡的哪一阶段来考虑,③用三段式列式计算。
根据以上分析解答此题。
(1)该实验目的是阴阳极同步产生H2O2和过硫酸铵[(NH4)2S2O8],电解池阳极发生氧化反应,阳极的溶液为(NH4)2SO4和稀H2SO4,阳极发生氧化反应的应该是溶液里的阴离子SO42-,阴极区发生还原反应生成H2O2,根据阴极区溶液H2SO4、Na2SO4以及左边有空气不断输入写出反应式:O2+2H++2e-=H2O2。
答案为:SO42- ;O2+2H++2e-=H2O2。
(2)根据表中数据分析,Cr3+加入的量最少,H2O2的分解率最大,所以能使过氧化氢分解反应活化能降低最多的离子是Cr3+,贮运H2O2时,要求容器材质不能促进H2O2分解,由表中数据可知选纯铝最好。
答案为:Cr3+; A。
(3) H2O2(aq)+Mn2+(aq)=OH(aq)+Mn3+(aq)+OH-(aq) ΔH=a kJ/mol
H2O2(aq)+Mn3+(aq)+2OH-(aq)=Mn2+(aq)+·O2- (aq)+2H2O(l) ΔH=b kJ/mol
OH(aq)+·O2-(aq)=O2(g)+OH-(aq) ΔH=c kJ/mol
根据盖斯定律可知以上三个反应相加可得2H2O2(aq)=2H2O(l)+O2(g),所以该反应的ΔH=(a+b+c)kJ·mol-1 。
答案为:(a+b+c)kJ·mol-1 。
(4)①a.由图可知,平衡时产物c(PO43-)=y mol·L1,但平衡时反应物浓度可能与生成物相同也可能不同,所以不能用c(H2PO2-)=y mol·L1判断反应是否达到平衡,a不能用来判断;
b.反应中要消耗OH,溶液的pH会发生变化,当pH不再变化就可以判断反应达到平衡,b可以用来判断;
c.v(H2O2)=2v(H2PO2-)未指明是正反应速率还是逆反应速率,无法判断,c不能用来判断;
d.反应中c(PO43-)和c(H2PO2-)分别是生成物与反应物,只要没有达到平衡,c(PO43-)/c(H2PO2-)的比值就在不断变化,当比值不再发生变化,就说明反应达到了平衡,d可以用来判断;
答案为:b d。
②由图可知从 tm到tn时c(PO43-)在不断增大,说明反应是在从左向右进行,正反应速率大于逆反应速率,tn时的生成物c(PO43-)浓度比tm时的要多,所以tm时v逆小于tn时v逆。
答案为:小于。
③若平衡时溶液的pH=12,用三段式计算:
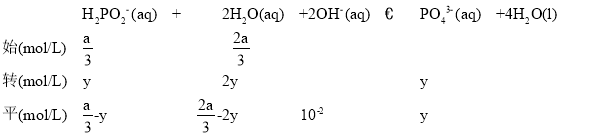
平衡常数k=
 。
。
答案为:(L/mol)4 。