【题目】氢气是一种清洁能源。可由CO和水蒸气反应制备,其能量变化如下图所示。

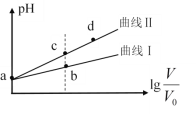
(1)该反应为可逆反应。在800 ℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则此反应的平衡常数为___,随着温度升高该反应的化学平衡常数的变化趋势是___。(填“变大”、“变小”或“不变”)
(2)某温度下,该反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是____(填字母)。
起始浓度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015 mol·L-1
D. 平衡时,乙中H2O的转化率大于25%
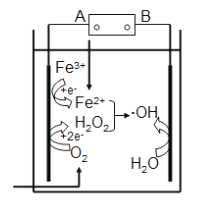
(3)一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,达到平衡后:
2NH3(g) ΔH<0,达到平衡后:
①加催化剂,v(正)、v(逆)都发生变化,且变化的倍数__(填“相等”或“不相等”)。
②缩小体积使体系压强增大,则v(正)___,v(逆)___(填“增大”、“减小”或“不变”),v(正)变化的倍数__v(逆)变化的倍数(填“大于”、“小于”或“等于”)。
③降温,v(正) ____,v(逆)__(填“增大”、“减小”或“不变”)。
④温恒压,再通入一定量的He,达到新平衡时,N2的转化率__,c(H2)将__(填“增大”、“减小”或“不变”)。
【题目】TK时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率小于60%