题目内容
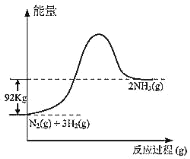
【题目】氢气是一种清洁能源。可由CO和水蒸气反应制备,其能量变化如下图所示。

(1)该反应为可逆反应。在800 ℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则此反应的平衡常数为___,随着温度升高该反应的化学平衡常数的变化趋势是___。(填“变大”、“变小”或“不变”)
(2)某温度下,该反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是____(填字母)。
起始浓度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015 mol·L-1
D. 平衡时,乙中H2O的转化率大于25%
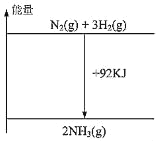
(3)一定条件下,可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,达到平衡后:
2NH3(g) ΔH<0,达到平衡后:
①加催化剂,v(正)、v(逆)都发生变化,且变化的倍数__(填“相等”或“不相等”)。
②缩小体积使体系压强增大,则v(正)___,v(逆)___(填“增大”、“减小”或“不变”),v(正)变化的倍数__v(逆)变化的倍数(填“大于”、“小于”或“等于”)。
③降温,v(正) ____,v(逆)__(填“增大”、“减小”或“不变”)。
④温恒压,再通入一定量的He,达到新平衡时,N2的转化率__,c(H2)将__(填“增大”、“减小”或“不变”)。
【答案】1 变小 CD 相等 增大 增大 大于 减小 减小 减小 减小
【解析】
(1)利用三段式列式计算;根据图中能量的转化关系判断反应是放热反应,再结合化学平衡常数与温度的关系作答;
(2)A. 根据浓度对化学反应速率的影响作答;
B. 设甲中转化的H2O(g)的浓度为xmol·L-1进行求解;再结合等效平衡思想分析丙中的转化率;
C. 结合转化率求出丙中的平衡浓度;
D. 利用等效平衡思想分析作答;
(3)根据外界因素对化学反应速率与化学平衡的综合影响分析作答。
(1) CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol·L-1) 2.0 3.0 0 0
转化浓度(mol·L-1) 1.2 1.2 1.2 1.2
平衡浓度(mol·L-1) 0.8 1.8 1.2 1.2
故平衡常数K=![]() =1;
=1;
根据能量变化关系图可知该反应为放热反应,温度升高,平衡向逆反应方向移动,平衡常数减小。
(2)A. 反应物浓度越大,反应速率越大,故开始时反应速率大小:甲<乙<丙,A项正确;
B. 设甲中转化的H2O(g)的浓度为xmol·L-1,则K=![]() ,故x=0.0025,即转化率为25%,丙中加入的CO(g)和H2O(g)的比与甲中相同,故转化率相同,B项正确;
,故x=0.0025,即转化率为25%,丙中加入的CO(g)和H2O(g)的比与甲中相同,故转化率相同,B项正确;
C. 平衡时,丙中c(CO2)是甲中的2倍,由于转化率为25%,故丙中c(CO2)=0.02 mol·L-1×25%=0.005 mol·L-1,C项错误;
D. 若乙中c(H2O)=0.01 mol·L-1,平衡时H2O的转化率等于25%,但乙中c(H2O)=0.02 mol·L-1,故其转化率小于25%,D项错误;
故答案选CD;
(3)可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
①加催化剂,v(正)、v(逆)会同等程度增大,故答案为:相等。
②缩小体积使体系压强增大,v(正)与v(逆)均增大,v(正)变化的倍数大于v(逆)变化的倍数,使平衡向正反应方向移动,知道最终v(正)与v(逆)相等,达到新的平衡状态,故答案为:增大;增大;大于;
③降温,化学反应速率减小,则v(正)与v(逆)均减小,故答案为:减小;减小;
④恒温恒压,再通入一定量的He,相当于增大反应气体的体积,反应物的浓度减小,等效于恒容条件下减小压强,则平衡会向逆反应方向移动,故达到新平衡时,N2的转化率减小,因体积增大导致c(H2)也将减小,故答案为:减小;减小。

【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
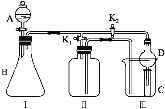
(1)用分析天平准确称取该样品5.0 g,全部溶于水配制成1 000.0 mL的溶液。用____(填仪器名称)量取20.00 mL放在锥形瓶中,滴加几滴酚酞,待测。该中和滴定中滴定终点的现象是___。
(2)用0.10 mol·L-1稀盐酸滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | 稀盐酸的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中NaOH的质量分数为______。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果____ (填“偏高”、“偏低”或“不变”,下同);若滴定过程中不慎将锥形瓶中溶液洒出,会使所测结果_____;若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果____。
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小