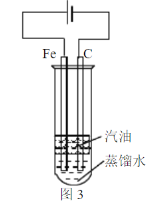
题目内容
【题目】1,6-己二酸是合成高分子化合物尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。如图是合成尼龙的反应流程:
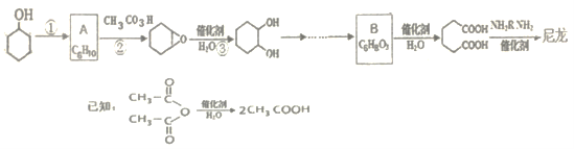
完成下列填空:
(1)写出反应类型:反应①_____反应②_______。
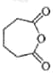
(2)A和B的结构简式为_______、_______。
(3)由![]() 合成尼龙的化学方程式为___。
合成尼龙的化学方程式为___。
(4)由A通过两步制备1,3-环己二烯的合成线路为:_______。
【答案】消去反应 加成(氧化)反应 ![]()
 n
n![]() +NH2RNH2
+NH2RNH2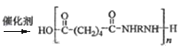 +(2n-1)H2O
+(2n-1)H2O 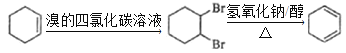
【解析】
根据A的分子式可知,A中含1个不饱和度,因此可推出A为环己烯,其结构简式为:![]() ,它是通过环己醇通过消去反应而得到,A经过氧化得到
,它是通过环己醇通过消去反应而得到,A经过氧化得到![]() ,
,![]() 与水在催化剂作用下生成
与水在催化剂作用下生成 ;根据已知信息,结合B在水的催化作用下生成
;根据已知信息,结合B在水的催化作用下生成 ,采用逆合成分析法可知B应为
,采用逆合成分析法可知B应为 其分子式正好为C6H8O3;最后
其分子式正好为C6H8O3;最后 经过缩聚反应合成尼龙,据此分析作答。
经过缩聚反应合成尼龙,据此分析作答。
根据上述分析可知,
(1)反应①的反应类型为:消去反应;反应②为加氧氧化过程,其反应类型为加成(氧化)反应,故答案为:消去反应;加成(氧化)反应;
(2)根据上述分析可知,A的结构简式为:![]() ;B的结构简式为:
;B的结构简式为: ,故答案为:
,故答案为:![]() ;
; ;
;
(3) 与NH2RNH2发生缩聚反应生成尼龙,其化学方程式为:n
与NH2RNH2发生缩聚反应生成尼龙,其化学方程式为:n![]() +NH2RNH2
+NH2RNH2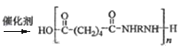 +(2n-1)H2O;
+(2n-1)H2O;
(4)A为![]() ,若想制备1,3-环己二烯,可先与溴的四氯化碳溶液发生加成反应生成1,2—二溴环己烷,1,2—二溴环己烷再在氢氧化钠乙醇溶液、加热的条件下发生消去反应生成1,3﹣环己二烯,其具体合成路线如下:
,若想制备1,3-环己二烯,可先与溴的四氯化碳溶液发生加成反应生成1,2—二溴环己烷,1,2—二溴环己烷再在氢氧化钠乙醇溶液、加热的条件下发生消去反应生成1,3﹣环己二烯,其具体合成路线如下: 。
。

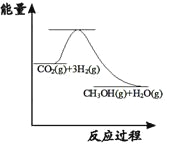
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJmol-1
2CO(g)+2H2(g) △H=+247.0 kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_______n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
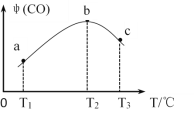
① T2℃时,CO体积分数最大的原因是_____________。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP =_______(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
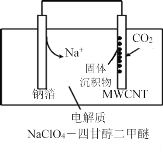
(4)2016年我国科研人员根据反应Na+CO2→ Na2CO3+C(未配平) 研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。