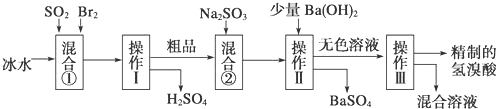
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻璃棒外,还需要的玻璃仪器有______;
(2)选择酚酞为指示剂进行滴定:
①盛装0.1000mol/L的盐酸标准液应该使用_____式滴定管;
②滴定时双眼应_______________;
③滴定终点的实验现象:___________。
(3)有关数据记录如下:
测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
① | 20.00 | 0.50 | 20.78 |
② | 20.00 | 1.20 | 21.32 |
计算纯度:烧碱样品的纯度是________;(取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果__________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果_______;
③读数时,滴定前仰视,滴定后俯视,会使测定结果__________;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果__________。
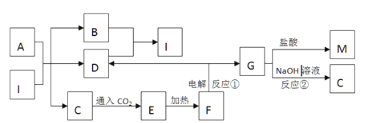
【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。
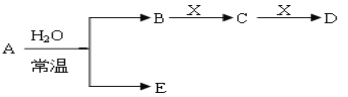
(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。