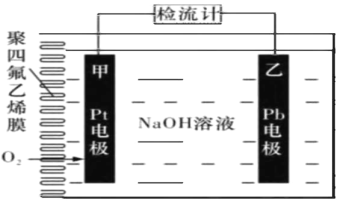
��Ŀ����
����Ŀ����ͼ��ʾ�й����ʵ��ת����ϵ������A����G��ij����ɫ������ɵĻ���I�dz�������ɫҺ�壬��Ӧ���ڻ���������������ҪӦ�ã����ֲ������������ȥ����

��1��д���������ʵĻ�ѧʽ��B_______��F_______��
��2����Ӧ�ڵ����ӷ���ʽΪ_______��
��3���ҹ��״�����G�������ͺ�ˮ��ɵĵ�أ��ں����������ż�����Ҫ�����ã��乤��ʱ������ӦʽΪ_______���õ�������ŵ���ֻ�貹��_______��������������������ϾͿɽ���ʹ�á�
��4����M��ˮ��Һ�м�������A�еĵ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ_______��
��5��25��ʱ��pH��Ϊ5�������M��ˮ��Һ�У���H2O�������H�����ʵ���Ũ��֮��Ϊ_______��
���𰸡�H2 Al2O3 2A1+2OH-+2H2O=2AlO2-+3H2�� O2��2H2O��4e����4OH�� ���� 4AlCl3+6Na2O2+6H2O=4Al��OH��3��+12NaCl+3O2�� 1��104
��������
I�dz�������ɫҺ�壬ӦΪH2O��A����G��ij����ɫ������ɵĻ����û������ˮ��Ӧ�õ�B��D��C����B��D��Ӧ����ˮ��B��D�ֱ�Ϊ�����������е�һ�֣�����֪AΪAl��Na2O2������CΪNaAlO2��EΪAl��OH��3��FΪAl2O3�����F�õ�D��G����GΪAl��DΪO2��BΪH2��G�����ᷴӦ����MΪAlCl3���ݴ˽��
I�dz�������ɫҺ�壬ӦΪH2O��A����G��ij����ɫ������ɵĻ����û������ˮ��Ӧ�õ�B��D�� C����B.��D��Ӧ����ˮ��B��D�ֱ�Ϊ�����������е�һ�֣�����֪AΪAl��Na2O2������CΪNaAlO2��EΪAl(OH)3��FΪAl2O3�����F�õ�D��G����GΪAl��DΪO2��BΪH2��G�����ᷴӦ����MΪAlCl3��
(1)������������֪��BΪH2��FΪAl2O3��
(2)��Ӧ��Ϊ��������������Һ��Ӧ�����ӷ���ʽΪ��2Al+2OH+2H2O�T2AlO2+3H2����
(3)��Al�������ͺ�ˮ��ɵĵ�أ�����������ԭ��Ӧ�������������ŵ��������������ӣ�����ʱ������ӦʽΪ��O2+4e+2H2O�T4OH����Ӧ��Al�����ģ�AlΪ�������õ�������ŵ���ֻ�貹�为�����ϾͿɼ���ʹ�ã��ʴ�Ϊ��O2+4e+2H2O�T4OH��������
(4)��AlCl3��ˮ��Һ�м���������ƣ���Ӧ�Ļ�ѧ����ʽΪ��4AlCl3+6Na2O2+6H2O=4Al��OH��3��+12NaCl+3O2����
(5)25��ʱ��pHΪ5��������Һ�У���H2O�������H+���ʵ���Ũ�ȵ�����Һ������������Ũ��Ϊ109mol/L��pHΪ5��AlCl3��ˮ��Һ��������Ũ��Ϊˮ�����������H2O�������H+���ʵ���Ũ��Ϊ105mol/L���ʶ�����H2O�������H+���ʵ���Ũ��֮��Ϊ109mol/L��105mol/L=1:104���ʴ�Ϊ��1:104��