题目内容
【题目】I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
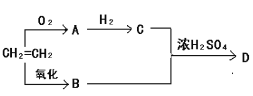
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
【答案】+135.6 大于 c(CO2)·c(H2O) 23.6 Mg 氧化 Mg-2e-=Mg2+ H2O2+2e-+2H+=2H2O 0.4NA或2.408×1023
【解析】
I.(1)①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) △H1=-127.4kJ/mol
②NaOH(s)+CO2(g)═NaHCO3(s) △H2=-131.5kJ/mol
①-2×②整理可得:2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g)的反应热;
根据反应热判断温度对该反应的影响,结合平衡常数的含义,进而可得不同温度下的K值大小;
(2)当碳酸钡、硫酸钡两种沉淀共存时,溶液中钡离子浓度为定值,根据溶度积计算;
II.负极发生氧化反应,正极发生还原反应(或活动性不同的电极,活泼的为负极,不活泼的为正极),正极上溶液中的溶质H2O2获得电子,发生还原反应,Mg是+2价金属,结合闭合回路中电子转移数目相等分析计算。
(1)①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) △H1=-127.4kJ/mol
NaOH(s)+CO2(g)═NaHCO3(s) △H2=-131.5kJ/mol
①-2×②得,2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g) △H =+135.6 kJ/mol;
由于该反应是吸热反应,升高温度,平衡正向移动,化学平衡常数增大,所以K313K>K298K;由于化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,固体物质不出现在平衡常数表达式中,生成物只有CO2、H2O是气体,所以根据平衡常数的含义,可得该反应的平衡常数表达式K=c(CO2)·c(H2O);
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中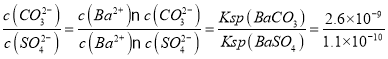 =23.6;
=23.6;
II.(1)在Mg﹣H2O2电池中,Mg失电子发生氧化反应生成Mg2+,所以Mg为负极,失去电子,发生氧化反应;
(2)负极上Mg失去电子,电极反应式为:Mg-2e-=Mg2+;正极上,溶液中H2O2获得电子,发生还原反应,电极反应式为:H2O2 +2e-+2H+=2H2O;
(3) 4.8gMg的物质的量为n(Mg)=4.8g÷24g/mol=0.2mol,由于Mg是+2价的金属,所以在整个闭合回路中电子转移数目为n(e-)=0.2mol×2×NA/mol=0.4NA。

 阅读快车系列答案
阅读快车系列答案【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ