题目内容
【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
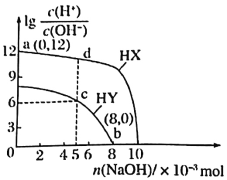
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。
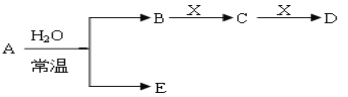
(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。
【答案】NaClO+2As+3H2O=2H3AsO4+5NaCl 5NA 3NO2+H2O=2HNO3+NO ![]() CO32-+H2O
CO32-+H2O![]() HCO3-+OH- Fe+4H++NO3-=Fe3++NO↑+2H2O 离子键和极性共价键 Al3++3AlO2-+6H2O=4Al(OH)3↓ N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-624kJ·mol-1 Cu+2H++H2O2=Cu2++2H2O 56L
HCO3-+OH- Fe+4H++NO3-=Fe3++NO↑+2H2O 离子键和极性共价键 Al3++3AlO2-+6H2O=4Al(OH)3↓ N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-624kJ·mol-1 Cu+2H++H2O2=Cu2++2H2O 56L
【解析】
根据元素在周期表中的位置分析元素的种类;根据氧化还原反应原理书写反应方程式;根据物质性质及转化关系分析物质种类并书写反应方程式及电子式;根据燃烧热计算反应热并书写热化学方程式;根据反应方程式及物质的量与体积的关系进行相关计算。
由元素在周期表中位置,可知①为H②为Na③为Al④为C.⑤为N⑥为O⑦为Cl;.
Ⅰ、Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂,则Y为NaClO,As可与Y的水溶液反应,物有As的最高价含氧酸,即生成H3AsO4,根据化合价升降相等可知还有NaCl生成,反应方程式为:5NaClO+2As+3H2O=2H3AsO4+5NaCl,As元素化合价由0升高为+5,转移电子数为5,故消耗1mol还原剂时,转移的电子个数为5NA,故答案为:5NaClO+2As+3H2O=2H3AsO4+5NaCl;5NA;
Ⅱ、能和水反应的物质有金属氧化物、非金属氧化物、金属和非金属。
(1)若E为氧化物,常温下与A与水反应生成E,则为二氧化氮与水反应生成硝酸与NO,故A为NO2,B为HNO3,E为NO,反应方程式为:3NO2+H2O=2HNO3+NO;
①当X是碱性盐溶液,C分子中有22个电子时,则X为碳酸盐,C为CO2,D为碳酸氢盐,则:C的电子式为![]() ,表示X呈碱性的离子方程式为CO32-+H2O
,表示X呈碱性的离子方程式为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
②当X为金属单质时,由转化关系可知,X为变价金属,故X为Fe,C为硝酸铁,D为硝酸亚铁,则X与B的稀溶液反应生成C的离子反应方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,D为白色沉淀,则A为Na或过氧化钠,E为氢气或氧气,B为NaOH,X为氯化铝,C为偏铝酸钠,D为氢氧化铝,B(NaOH)含有的化学键类型为:离子键、共价键,C与X反应的离子方程式为 Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的主要成分,则该化合物为N2H4,1molN2H4燃烧放出的热量为31.2kJ×1mol×32g/mol1.6g=624kJ,该反应热化学方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624kJ·mol-1;
(4)双氧水有强氧化性,酸性条件下,双氧水能氧化铜生成铜离子同时生成水,反应离子方程式为:Cu+2H++H2O2=Cu2++2H2O;
(5)氢气和钠反应生成氢化钠,氢化钠和水反应生成氢氧化钠和氢气,氢氧化钠和铝反应生成氢气,反应方程式为:NaH+H2O=NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1mol氢化钠和水反应生成1mol氢氧化钠和1mol氢气,1mol氢氧化钠和铝反应生成1.5mol氢气,故标况下生成氢气体积为(1mol+1.5mol)×22.4L/mol=56L。