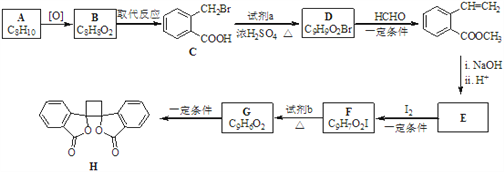
��Ŀ����
����Ŀ��ʵ������NH4HCO3��NaHSO3�ĸ����״����ij��ѧ��ȤС��ⶨ����NH4HCO3�ĺ�����С���ͬѧ������ڻ�����м����ʵ�鷽�����ⶨ����NH4HCO3��������������SO2������KMnO4�ķ�Ӧԭ����SO2��MnO4����H����SO42����Mn2����H2O���ش��������⣺
��1����ѧС��Ҫ��ѡ��������ҩƷ����������ʵ�飨ͼ��ÿ������װ��ֻѡ����һ�Σ�����̨�ȹ̶�����δ������
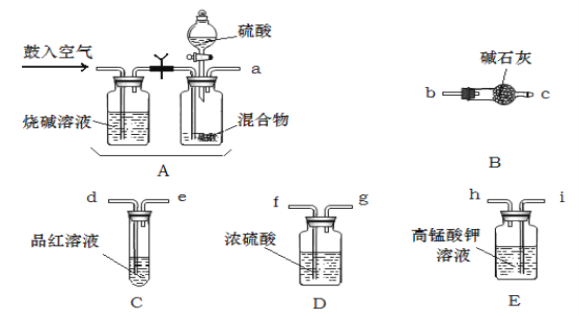
�밴�����������ҵķ���,��������˳���ǡ��������Ľӿ���ĸa��b...)a��_______f��g��_______��
��2��ʵ�鿪ʼ����������ǰ��Aװ����Ҫ��������������ǣ������Aװ���ٴι��������������_______��
��3��Eװ�õ������ǣ�_______��
��4��ʵ���У�����C�Թ�����Һ��ɫ����ô�ⶨ������ܻ�ƫ_______��Ϊ��ȷ��ʵ����C�Թ�����Һ����ɫ������ȡ��Ʒ������Ϊmg��ʵ��ǰE����װamol��L��1��KMnO4��Һ�����V��Ӧ����______mL��
��5������������Ʒ����Ϊ9.875g,������ú��ʯ������4.4g����ô�������NH4HCO3����������Ϊ_______��
��6���Ӷ����ⶨ��ȷ�ԵĽǶȿ��ǣ�����װ�û�Ӧ����һ���ĸĽ����Ľ��Ĵ�ʩ��_______��
���𰸡�i-h-d-e b-c �ų�װ���е�ԭ�п����������ɵ�����ȫ���������װ�û�ʹ��Ӧ���ɵ�SO2��CO2�ܱ���ȫ���� ��ȥSO2����ֹ�Բⶨ������� �� ![]() 80�� B֮���һ����ֹ������ˮ��CO2����B��װ��
80�� B֮���һ����ֹ������ˮ��CO2����B��װ��
��������
����ʵ��Ŀ�ļ����ʵ����ʷ���ʵ��װ�õ�����˳����ʵ��ԭ������ʵ�������ע���������������ԭ��Ӧ�е���ת���غ������ؼ��㡣
(1)����ʵ��ԭ�����������м������������̼�Ͷ����������壬�ø��������Һ��ȥ��������Ȼ��ͨ��Ʒ����Һ������������Ƿ���������Ž�����ͨ��Ũ����������ü�ʯ�����ն�����̼���壬��ʯ�����ӵ�������Ϊ������̼���������������װ������˳����a-i-h-d-e-f-g-b-c���ʴ�Ϊ�� i-h-d-e��b-c��
(2)ʵ�鿪ʼ����������ǰ��Aװ����Ҫ�������Ŀ�����ų�ϵͳ�еĶ�����̼���壬������ٴι��������������ʹ���ɵ�����ȫ���������װ�ã��ʴ�Ϊ���ų�װ����ԭ�п����������ɵ�����ȫ���������װ�ã�
(3)���������Һ�����������ն����������壬��ֹ��������Բⶨ�����Ӱ�죬�ʴ�Ϊ�����ն����������壬��ֹ��������Բⶨ�����Ӱ�죻
(4)��Ʒ����Һ��ɫ��˵��������������û�г�����������ʯ�����գ����Լ�ʯ��������ƫ����ʵ��ԭ��������֪������̼���������ƫ����������NH4HCO3ƫ�ⶨ�����ƫ�ߣ�Ϊ�˱�֤���������ܱ�ȫ�����գ����Լٶ�mg��Ʒȫ��NaHSO3���м��㣬�����ԭ���غ���Ʒ�в���������������ʵ���Ϊ![]() �����ݶ��������������ط�Ӧ����ʽ�ɵ�5SO2~2MnO4������
�����ݶ��������������ط�Ӧ����ʽ�ɵ�5SO2~2MnO4������![]() ��V=
��V=![]() mL ���ʴ�Ϊ���ߣ�
mL ���ʴ�Ϊ���ߣ�![]() ��
��
(5)��ʯ������4.4g����������̼���ʵ���Ϊ0.1mol����̼Ԫ���غ㣬̼��������ʵ���ҲΪ0.1mol��̼���������Ϊ7.9g��NH4HCO3����������Ϊ7.9g/9.875g��100%=80%���ʴ�Ϊ��80%��
(6)�Ӹ�װ�ò��������ʼ���װ�ýṹ�������Ӷ����ⶨ��ȷ�ԵĽǶȿ��ǣ�����װ�û�Ӧ����һ���ĸĽ����Ľ��Ĵ�ʩ��B֮���һ����ֹ������ˮ��CO2����B��װ�á�

����Ŀ����NaΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 =a kJ mol -1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 =bkJ mol-1
���ܶ��壺�ڱ�״���£���1 mol��̬����AB(g)����Ϊ��̬ԭ��
A(g)��B(g)�������������֪1 mol�����ļ���ΪxkJ�������������� ����ʾ������˵����ȷ����
��ѧ�� | C��O | C��H | O��H |
����/(kJ mol-1) | 798 | 413 | 463 |
A.������x=![]()
B.H2O(g) = H2O(1)����S<0����H=(a �� b) kJ mol -1
C.����4NA��O��H������ʱ����Ӧ�ų�������Ϊa kJ
D.���÷�Ӧ����Ƶ�ԭ��ص�⾫��ͭ�����������0.2NA������ʱ. �����ϵ��۵�������������6.4 g