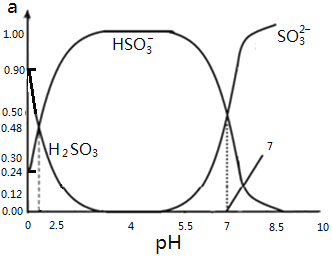
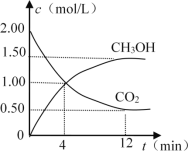
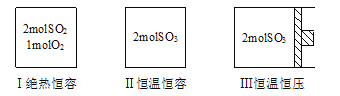
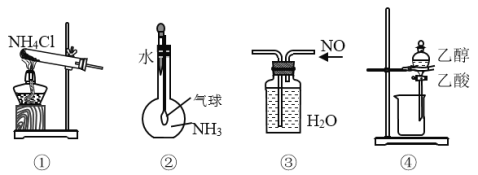
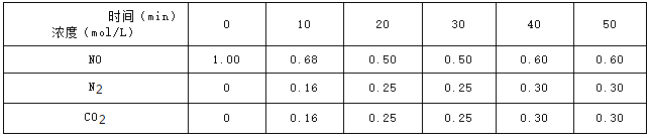
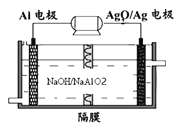
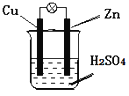
0 196117 196125 196131 196135 196141 196143 196147 196153 196155 196161 196167 196171 196173 196177 196183 196185 196191 196195 196197 196201 196203 196207 196209 196211 196212 196213 196215 196216 196217 196219 196221 196225 196227 196231 196233 196237 196243 196245 196251 196255 196257 196261 196267 196273 196275 196281 196285 196287 196293 196297 196303 196311 203614