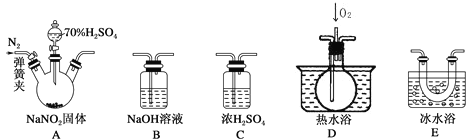
题目内容
【题目】合理利用资源,加强环境保护,降低碳的排放,实施低碳经济是今后经济生活主流。
(1)下列措施不利于有效减少二氧化碳排放的是___。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
D.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
E.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4比例混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2![]() ______+2H2O。
______+2H2O。
(3)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)能判断该反应已达化学反应限度的标志是____(填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度的标志是____(填字母)。
A.CO2百分含量保持不变
B.容器中H2浓度与CO2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO2的生成速率与CH3OH的生成速率相等
现测得CO2和CH3OH(g)的浓度随时间变化如图所示。
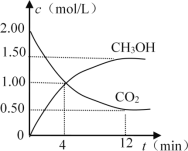
从反应开始到平衡,氢气的平均反应速率v(H2)= _____mol/(L·min)。
(4)以KOH为电解质的甲醇燃料电池总反应为:2CH3OH+3O2+4KOH = 2K2CO3+6H2O,通入甲醇的电极为燃料电池的___极,正极发生的电极反应式为______。
【答案】B CH4 AD 0.375 负 O2+2H2O+4e-=4OH-
【解析】
(1)A.植树造林保护森林,保护植被,能增强光合作用,大量消耗二氧化碳;
B.加大对煤和石油的开采,并鼓励使用石油液化气,能增加二氧化碳的排放;
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高,节约用电、用气,可以节能减排;
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率,可以减少废气的排放和节约能源;
E.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率,减少石油化石燃料的使用,可以减少废气的排放和节约能源。
(2)根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式;
(3)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;根据v= ![]() 计算v(CO2),再利用速率之比等于化学计量数之比计算v(H2);
计算v(CO2),再利用速率之比等于化学计量数之比计算v(H2);
(4)燃料电池中燃料在负极失电子发生氧化反应,碱溶液中生成碳酸钾,氧气在正极得到电子生成氢氧根离子。
(1)
A.植树造林,保护森林,保护植被,能增强光合作用,大量消耗二氧化碳,不符合题意,故A错误;
B.加大对煤和石油的开采,并鼓励使用石油液化气,能增加二氧化碳的排放,符合题意,故B正确;
C.积极推进核能、风能、潮汐能建设,大力推行太阳能的综合开发能减少二氧化碳的排放,不符合题意,故C错误;
D.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高,能减少电的使用,减少煤和石油化石燃料的使用,减少二氧化碳的排放,不符合题意,故D错误;
E.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率,减少石油化石燃料的使用,可以减少废气的排放和节约能源,不符合题意,故E错误;
答案为B。
(2)根据质量守恒定律的微观解释可以知道:反应前后的原子数目和种类应该相等,分析题给的化学反应方程式可以知道,反应前出现了2个O,1个C,8个H,反应后出现了2个O,4个H,所以在X中含有4个H和1个C,即X为CH4;
答案为CH4。
(3)
A.平衡时各物质的浓度保持不变,CO2百分含量保持不变,说明到达平衡,故A正确;
B.开始投料比,6mol H2和2mol CO2,方程式系数比3:1,则容器中H2浓度与CO2浓度之比始终为3:1,所以不能证明达平衡状态,故B错误;
C.容器的体积不变,反应前后都为气体,容器中混合气体的质量始终保持不变,不能说明到达平衡,故C错误;
D.CO2生成速率表示逆反应速率,与CH3OH生成速率表示正反应速率,两者相等,说明到达平衡,故D正确;
由图可知,12min到达平衡时二氧化碳的浓度变化量为2mol/L-0.5mol/L=1.5mol/L,所以v(CO2)= ![]() =0.125mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(CO2)=3×0.125mol/(Lmin)=0.375mol/(Lmin);
=0.125mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(CO2)=3×0.125mol/(Lmin)=0.375mol/(Lmin);
答案为AD;0.375。
(4)甲醇-空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则通入甲醇的电极为燃料电池的负极,氧气在正极得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;
答案为负;O2+2H2O+4e-=4OH-。

【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
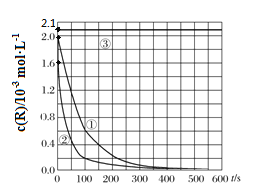
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液