题目内容
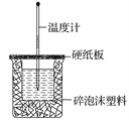
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。
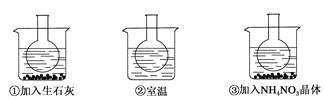
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
【答案】CH3COONa溶液中存在如下水解平衡:CH3COO-+H2OCH3COOH+OH-,使溶液呈碱性 BD 右 左 左 右 ④<②<③<①
【解析】
(1) CH3COONa是强碱弱酸盐,水解呈碱性;
(2)向烧杯①中加入生石灰,生石灰与水反应放热,温度升高;烧瓶③中溶液红色变浅,说明CH3COO-+H2OCH3COOH+OH-平衡逆向移动;
(3)根据影响平衡移动的因素分析;
(4)根据盐水解分析;
(1) CH3COONa溶液中存在如下水解平衡:CH3COO-+H2OCH3COOH+OH-,使溶液呈碱性,所以溶液显浅红色;
(2)向烧杯①中加入生石灰,生石灰与水反应放热,温度升高,烧瓶①中溶液红色变深,说明CH3COO-+H2OCH3COOH+OH-平衡正向移动,水解反应为吸热反应,故A错误、B正确;水解反应为吸热反应,烧瓶③中溶液红色变浅,说明CH3COO-+H2OCH3COOH+OH-平衡逆向移动,NH4NO3溶于水时吸收热量,故C错误、D正确。
(3)向0.01 mol·L-1 CH3COONa溶液中加入少量浓盐酸,氢氧根离子离子浓度减小,CH3COO-+H2OCH3COOH+OH-正向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量NaOH固体,氢氧根离子浓度增大,CH3COO-+H2OCH3COOH+OH-逆向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量Na2CO3固体,氢氧根离子浓度增大,CH3COO-+H2OCH3COOH+OH-逆向移动;向0.01 mol·L-1 CH3COONa溶液中加入少量FeSO4固体,氢氧根离子浓度减小,CH3COO-+H2OCH3COOH+OH-正向移动;
(4)①CH3COONa强碱弱酸盐,水解呈碱性、②NH4Cl是强酸弱碱盐,水解呈酸性、③CH3COONH4 是弱酸弱碱盐,水解程度相同,溶液呈中性、④(NH4)2SO4强酸弱碱盐,溶液呈酸性,铵根离子浓度大于NH4Cl,酸性比NH4Cl溶液强,故pH由小到大排列的正确顺序为④<②<③<①。

 应用题天天练四川大学出版社系列答案
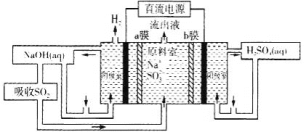
应用题天天练四川大学出版社系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为______(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是_____。(用化学式回答)
(3)由①、④、⑤三种元素形成化合物的电子式______ 。
(4)⑥的单质与NaOH溶液反应的离子方程式_______。
(5)⑦的氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1 g氢化物自燃放出45.0 kJ的热量(产物水为液态),其热化学方程式为_________。
(6)由表中元素形成的常见物质A、B、C、D、E、F转化关系如下图所示。已知:A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体, E的相对分子质量比D大17 ,D为红棕色气体(部分反应中生成物没有全部列出,反应条件未列出)

①A的结构式为_______。
②A和B反应生成C和F的化学方程式为_______,反应Ⅰ的离子方程式为________。
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D