题目内容
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原![]() 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=akJmol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=bkJmol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________ kJmol-1用含a、b的代数式表示![]() ;
;
(2)用活性炭还原法可以处理氮氧化物![]() 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
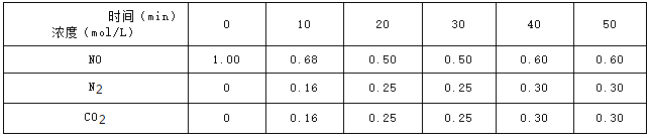
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 ①
①![]() 内,NO的平均反应速率
内,NO的平均反应速率![]() _________,
_________,![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() _________;
_________;
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________ ![]() 填字母编号
填字母编号![]() .
.
![]() 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
![]() 加入合适的催化剂
加入合适的催化剂 ![]() 适当缩小容器的体积
适当缩小容器的体积
③若30min后升高温度至![]() ,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,则Q____________
,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,则Q____________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ________填选项编号
![]() .
.
![]() 单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的温度不再发生改变
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
![]() 反应体系的压强不再发生改变
反应体系的压强不再发生改变
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示:
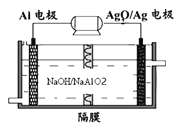
请写出该电池正极反应式__________常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的![]() ___________
___________![]() 不考虑溶液体积的变化
不考虑溶液体积的变化![]() 。
。
【答案】![]()
![]()
![]() ad
ad ![]() bc
bc ![]() 2
2
【解析】
(1)依据热化学方程式和盖斯定律分析计算;
(2)①根据v=![]() 计算;根据表格数据,20min是为平衡状态,结合平衡常数等于生成物物质的浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算;
计算;根据表格数据,20min是为平衡状态,结合平衡常数等于生成物物质的浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算;
②根据30min后的数据计算判断平衡常数,判断温度是否改变;再结合影响平衡的因素分析判断;
③容器中NO、N2、CO2的浓度之比为3∶1∶1,平衡向逆反应方向移动,升温平衡向吸热反应方向进行;
④依据影响化学平衡的因素和平衡移动原理分析判断;
(3)Al-Ag2O电池中铝为负极,Ag2O为正极,正极上氧化银得电子和水反应生成银和氢氧根离子,据此书写电极反应式;消耗27mg Al失去电子0.003mol,电解硫酸铜溶液,结合阳极的反应式4OH――4e-=2H2O+O2↑分析计算。
(1)①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJmol-1,②3AlCl(g)=2Al(l)+AlCl3(g) △H=b kJmol-1,依据盖斯定律①×3+②×6得到:6Al2O3(s)+18C(s)=12Al(l)+18CO(g)△H=(3a+6b)kJ/mol,即Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(0.5a+b)kJ/mol,故答案为:0.5a+b;
(2)①0~10min内,NO的平均反应速率v(NO)=![]() =0.032molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.25mol/L;c(CO2)=0.25mol/L;c(NO)=0.5mol/L;反应的平衡常数K=
=0.032molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.25mol/L;c(CO2)=0.25mol/L;c(NO)=0.5mol/L;反应的平衡常数K=![]() =
=![]() =0.25,故答案为:0.032molL-1min-1;0.25;
=0.25,故答案为:0.032molL-1min-1;0.25;
②30min后,根据图表数据得改变条件后的平衡常数计算K=![]() =
=![]() =0.25,平衡常数保持不变,说明改变的条件一定不是温度;依据数据分析,NO、N2、CO2的浓度均增大;a.通入一定量的NO,NO、N2、CO2的浓度均增大,故a正确;b.加入一定量的活性炭,碳是固体对平衡无影响,NO、N2、CO2的浓度均不变,故b错误;c.加入合适的催化剂,催化剂只改变化学反应速率,NO、N2、CO2的浓度均不变,故c错误;d.适当缩小容器的体积,NO、N2、CO2的浓度均增大,故d正确;故答案为:ad;
=0.25,平衡常数保持不变,说明改变的条件一定不是温度;依据数据分析,NO、N2、CO2的浓度均增大;a.通入一定量的NO,NO、N2、CO2的浓度均增大,故a正确;b.加入一定量的活性炭,碳是固体对平衡无影响,NO、N2、CO2的浓度均不变,故b错误;c.加入合适的催化剂,催化剂只改变化学反应速率,NO、N2、CO2的浓度均不变,故c错误;d.适当缩小容器的体积,NO、N2、CO2的浓度均增大,故d正确;故答案为:ad;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3∶1∶1,说明平衡向逆反应方向移动,说明逆反应是吸热反应,则正反应是放热反应,故答案为:<;
④恒容条件下,体积不变。a、无论反应是否达到平衡状态,单位时间内生成2n mol NO(g)的同时都消耗n mol CO2(g),故a错误;b、该反应是放热反应,所以反应体系的温度随着反应的进行而改变,当反应体系的温度不变,说明达到平衡状态,故b正确;C、反应中有固体参加,反应前后气体的质量不等,所以当混合气体的密度不再变化时,反应达到平衡,故c正确;d、无论反应是否达到平衡状态,压强始终不变,故d错误;故答案为:bc;
(3)Al-Ag2O电池中铝为负极,Ag2O为正极,正极上氧化银得电子和水反应生成银和氢氧根离子,电极反应式为:Ag2/span>O+2e-+H2O=2Ag+2OH-;消耗27mg Al失去电子0.003mol,电解硫酸铜溶液,阳极的反应式为4OH――4e-=2H2O+O2↑,根据反应中得失电子数相等,放电的氢氧根离子的物质的量=0.003mol,溶液中增加的氢离子物质的量为0.003mol,则溶液中氢离子的浓度=![]() =0.01mol/L,pH=-lg0.01mol/L=2,故答案为:Ag2O+2e-+H2O=2Ag+2OH-;2。
=0.01mol/L,pH=-lg0.01mol/L=2,故答案为:Ag2O+2e-+H2O=2Ag+2OH-;2。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:
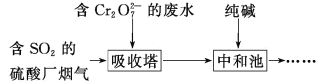
①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
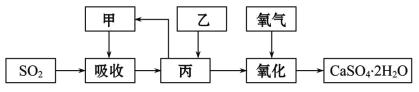
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:
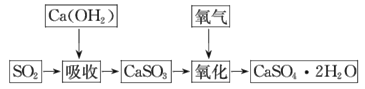
烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)