��Ŀ����
����Ŀ�������£���0.10 mol��L-1������ε���20.00 mL 0.10 mol��L-1��ˮ�У���Һ��pH��pOH�������������仯������ͼ��ʾ����֪��pOH= -lg c(OH-)������˵����ȷ���ǣ� ��
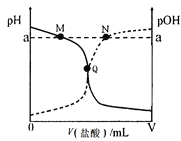
A. M����ʾ��Һ�У�c(NH4+)+c(NH3��H2O)= c(Cl-)
B. N����ʾ��Һ�У�c(NH4+)>c(Cl-)
C. Q����ʾ���������������ڰ�ˮ�����
D. M���N����ʾ��Һ��ˮ�����ӻ���ͬ
���𰸡�D
��������
��֪����ʱˮ�ĵ��볣��Ϊ1![]() 10-14����������ߵ�Q��ʱ��Һ��pH=pOH=7��Q��ʱ��Һ�����ԣ�����ΪNH4Cl��NH3��H2O��Q�������ҺΪ���ԣ�Q���Ҳ���ҺΪ���ԡ�
10-14����������ߵ�Q��ʱ��Һ��pH=pOH=7��Q��ʱ��Һ�����ԣ�����ΪNH4Cl��NH3��H2O��Q�������ҺΪ���ԣ�Q���Ҳ���ҺΪ���ԡ�
A����ݵ���غ��c(H+)+c(NH4+)=c(OH-)+ c(Cl-)����M��ӵ������Q���٣���ҺΪ���ԣ���c(H+)<c(OH-)����c(NH4+)>c(Cl-)����A�����
B����ݵ���غ��c(H+)+c(NH4+)=c(OH-)+ c(Cl-)����N��ӵ������Q��࣬��ҺΪ���ԣ���c(H+)>c(OH-)����c(NH4+)>c(Cl-)����B�����
C����ݷ�����Q��ʱ��Һ�����ԣ�����ΪNH4Cl��NH3��H2O�������ĵ��������С�ڰ�ˮ���������C�������
D�M����ҺΪ���ԣ���pH=a����ˮ�������c(H+)=10-amol/L��N����ҺΪ���ԣ�pOH=a����ˮ�������c(OH-)=10-amol/L������ˮ�������H+��OH-ʼ����ȣ���M���N�������ˮ�������c(H+)= c(OH-)=10-amol/L����ˮ�ĵ���̶���ͬ����D����ȷ��
����������������ȷ��ΪD��

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����Ŀ��ˮ���������Ǵ������������Ҫ�ɷ�,�о��仯ѧ��ɶ�������������Ⱦ�����ش����壬ij�������������ᆳ�������Ҫ��Ԥ�������������Һ��������ɫ����ȷ��������������NH4+��Na+��Mg2+��Ca2+��Al3+��SO42-��NO3-��CO32-��Cl-��ijͬѧ�����ٽ������µ�ʵ��:
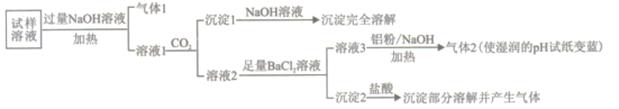
��֪���ڼ�����ǿ����������,�����ʿ��Խ�NO3-��ԭΪ������
�ش���������:
��1��������1���ĵ���ʽΪ_________��
��2������������1�������ӷ���ʽΪ________��
��3��������2���ijɷ���___________(�ѧʽ)��
��4������Һ3![]() ����2�������ӷ���ʽΪ_________��
����2�������ӷ���ʽΪ_________��
��5����������ʵ����ƶϸõ���������������__________�����ϵ�(�����ӷ���)��
��6����֪�����������и�Ԫ�ص���Ⱦ�������±�:
Ԫ�� | N | S | Na��Mg��Cl | Al | Ca |
��Ⱦ���� | ������β�� | ȼú��Ⱦ | �������� | �����ﳾ | �����۳� |
����ʵ�������жϸõ���������������Ⱦ������___________��