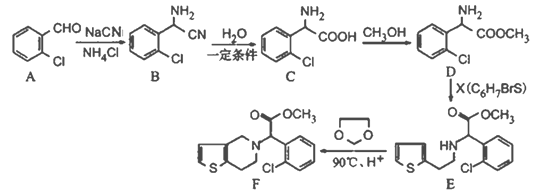
题目内容
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,可用于除油污,写出CO32﹣水解的离子方程式_______________________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式_______________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中
c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为_____(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)。可使溶液A和溶液B的 pH相等的方法是___。
A 向溶液A中加适量NaOH B 向溶液A中加适量水
C 向溶液B中加适量NaOH D 向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是______。
A.c(Na+)>2c(SO32-)>c(HSO3-)
B.c(Na+)=c(SO32﹣) +c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)> c(H+)=c(OH﹣)
②利用如图中数据,求H2SO3![]() H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
【答案】CO32﹣+H2O![]() HCO3﹣+OH﹣ 3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑ c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣) AD A 0.27
HCO3﹣+OH﹣ 3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑ c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣) AD A 0.27
【解析】
(1)①CO32﹣水解分步进行,弱酸根水解呈碱性;
②NaHCO3溶液和Al2(SO4)3溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(2)含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应,生成0.1mol NaNO3、0.1mol NaNO2,溶液体积为1L,则NaNO3、 NaNO2的浓度都是0.lmolL﹣1;HNO2酸性大于CH3COOH,所以CH3COO﹣水解程度大于NO2﹣,B溶液的pH大于A;
(3)①由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),
中性溶液则c(H+)═c(OH-),由图可知pH=7时,c(SO32-)=c(HSO3-)。
②H2SO3![]() H++ HSO3﹣的平衡常数
H++ HSO3﹣的平衡常数![]() 。
。
(1)①CO32﹣水解的离子方程式是CO32﹣+H2O![]() HCO3﹣+OH﹣;
HCO3﹣+OH﹣;
②NaHCO3溶液和Al2(SO4)3溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应离子方程式是3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑;
(2)硝酸是强酸,NO3﹣不水解;HNO2的电离常数Ka=7.1×10﹣4molL﹣1、CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,HNO2酸性大于CH3COOH,CH3COO﹣水解程度大于NO2﹣;同浓度的NaNO3、 NaNO2、CH3COONa溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);溶液A为硝酸钠和亚硝酸钠的混合液,其pH小于溶液B,要使pH相等,可以增大A的pH或减小B的pH;A、 向溶液A中加适量NaOH,A的pH增大; B、 向溶液A中加适量水,A的pH减小; C、 向溶液B中加适量NaOH,B的pH增大; D、 向溶液B中加适量水,B的pH减小,故选AD;
(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),由图可知pH=7时,c(SO32-)=c(HSO3-),则c(Na+)>2c(SO32-)>c(HSO3-),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),图可知pH=7时c(SO32-)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH-),故C错误;
D、由图可知pH=7时,c(SO32-)=c(HSO3-),所以离子浓度为c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-),故D错误;
②根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,H2SO3![]() H++ HSO3﹣的平衡常数
H++ HSO3﹣的平衡常数![]() 0.27。
0.27。

 名校课堂系列答案
名校课堂系列答案【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)