19. 已知下列数据:
已知下列数据:
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
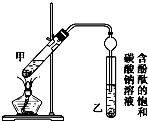
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
表中数据x的范围是1.57<X<1.76;实验①②⑤探究的是增加乙醇或乙酸的用量对酯产量的影响.
0 172908 172916 172922 172926 172932 172934 172938 172944 172946 172952 172958 172962 172964 172968 172974 172976 172982 172986 172988 172992 172994 172998 173000 173002 173003 173004 173006 173007 173008 173010 173012 173016 173018 173022 173024 173028 173034 173036 173042 173046 173048 173052 173058 173064 173066 173072 173076 173078 173084 173088 173094 173102 203614
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |


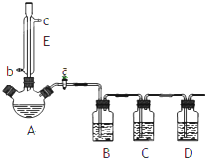 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.




