题目内容
19. 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
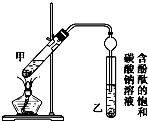
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
分析 (1)添加试剂的顺序是先加入密度小的,再加入密度大的;依据浓硫酸性质分析其在反应中的作用;根据酯化反应原理酸脱羟基醇脱氢写出反应的化学方程式;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)乙醇、乙酸的沸点较低,易挥发;根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离,必须使用的仪器为分液漏斗;乙酸乙酯的密度较小,在混合液上层,所以乙酸乙酯从分液漏斗的上口倒出;
(4)根据反应物浓度对化学平衡的影响分析;对照实验①②⑤条件的异同分析探究的目的.
解答 解:(1)浓硫酸密度大于水,且溶于水放出大量热,应该将浓硫酸加入乙醇中,所以操作方法为:将浓H2SO4加入乙醇中,边加边振荡,然后再加入乙酸或先将乙醇与乙酸混合好后再加浓硫酸并在加入过程中不断振荡;浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用;酯化反应中,羧酸脱去羟基,醇脱去氢原子,所以该反应的化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;催化剂 吸水剂;CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以BC正确,
故答案为:BC;
(3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,振荡时乙酸和碳酸钠反应而使溶液红色变浅;乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗;乙酸乙酯密度小于碳酸钠溶液,分液时从分液漏斗的上口倒出,
故答案为:减少乙酸乙醇的挥发,减少副反应的发生;试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;分液漏斗;上口倒;
(4)因在乙酸的物质的量相同条件下,增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯的物质的量减少,所以1.57<X<1.76,根据实验①②⑤条件的异同可知,实验①②⑤探究的是增加乙醇或乙酸的用量对酯产量的影响,
故答案为:1.57<X<1.76;增加乙醇或乙酸的用量对酯产量的影响.
点评 本题考查了乙酸乙酯的制备方法,注意把握乙酸乙酯的制备原理和实验方法,明确乙酸乙酯与乙酸、乙醇性质的区别方法及浓硫酸的作用.题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在利用重结晶的方法制备KNO3的过程中,可在漏斗中加入酒精来洗涤 | |
| B. | 在石油的分馏实验中,冷凝管中冷水应从上口进入,热水从下口流出 | |
| C. | 粗盐提纯中,在溶解粗盐时,应用大量的水来溶解,以防止食盐不完全溶解 | |
| D. | 在分液实验中,待液体静置分层后,上、下层液体都应分别从分液漏斗下端的活塞放出 |

 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: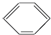 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0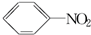 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$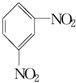 +H2O
+H2O