题目内容
15.某实验小组利用Fe2O3、Cu2O的混合物制取较纯净的胆矾(CuSO4•5H2O),实验方案如下:
(1)稀硫酸溶解混合物时发生反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O、Fe2O3+2H+═Fe2++H2O、、Cu+2Fe3+═2Fe2++Cu2+.
(2)溶液乙中加入适量CuO时发生反应的离子方程式为3CuO+2Fe3++3H2O═2Fe(OH)3+3Cu2+.
(3)操作Ⅰ主要包括蒸发浓缩、冷却结晶、过滤、洗涤、晾干等步骤.
(4)实验室还可以利用沉淀丙制取FeCO3,流程如下:

写出上述转化过程①、②、③中发生反应的离子方程式:
过程①:Fe(OH)3+3H+═Fe3++3H2O.
过程②:Fe+2Fe3+═3Fe2+.
过程③:2HCO3-+Fe2+═FeCO3↓+CO2↑+H2O.
分析 Fe2O3、Cu2O的混合物溶于过量的硫酸,氧化亚铜在酸性条件下生成铜离子和铜单质,氧化铁溶于酸生成铁离子,铜单质被铁离子氧化成铜离子,所以得到的溶液甲中含有亚铁离子、铜离子、铁离子等,加入双氧水将亚铁离子氧化成铁离子,再用氧化铜调节溶液的pH值,使铁离子沉淀,得到丙为氢氧化铁,溶液丁为硫酸铜溶液,将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、晾干得硫酸铜晶体,氢氧化铁中加入盐酸生成氯化铁,氯化铁再与铁反应生成氯化亚铁,氯化亚铁溶液中加入碳酸氢铵,过滤洗涤得碳酸亚铁,据此答题.
解答 解:Fe2O3、Cu2O的混合物溶于过量的硫酸,氧化亚铜在酸性条件下生成铜离子和铜单质,氧化铁溶于酸生成铁离子,铜单质被铁离子氧化成铜离子,所以得到的溶液甲中含有亚铁离子、铜离子、铁离子等,加入双氧水将亚铁离子氧化成铁离子,再用氧化铜调节溶液的pH值,使铁离子沉淀,得到丙为氢氧化铁,溶液丁为硫酸铜溶液,将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、晾干得硫酸铜晶体,氢氧化铁中加入盐酸生成氯化铁,氯化铁再与铁反应生成氯化亚铁,氯化亚铁溶液中加入碳酸氢铵,过滤洗涤得碳酸亚铁,
(1)稀硫酸溶解混合物时发生反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O、Fe2O3+2H+═Fe2++H2O、Cu+2Fe3+═2Fe2++Cu2+,
故答案为:Fe2O3+2H+═Fe2++H2O、Cu+2Fe3+═2Fe2++Cu2+;
(2)溶液乙中含有铁离子,加入适量CuO与酸反应,使得铁离子产生氢氧化铁沉淀,发生反应的离子方程式为 3CuO+2Fe3++3H2O═2Fe(OH)3+3Cu2+,
故答案为:3CuO+2Fe3++3H2O═2Fe(OH)3+3Cu2+;
(3)根据上面的分析可知,操作Ⅰ主要包括蒸发浓缩、冷却结晶、过滤、洗涤、晾干等步骤,
故答案为:蒸发浓缩、冷却结晶;
(4)根据上面的分析可知,反应①的离子方程式为Fe(OH)3+3H+═Fe3++3H2O,反应②的离子方程式为Fe+2Fe3+═3Fe2+,反应③的离子方程式为2HCO3-+Fe2+═FeCO3↓+CO2↑+H2O,
故答案为:Fe(OH)3+3H+═Fe3++3H2O;Fe+2Fe3+═3Fe2+;2HCO3-+Fe2+═FeCO3↓+CO2↑+H2O.
点评 本题考查实验的设计及评价,以及物质的组成及含量的测定,本题难度较大,做题时注意把握题给信息.

| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2 Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 改变温度时,该反应的平衡常数可能增大,可能减小 |
 在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:(1)平衡时CO的转化率为75%;该反应在该温度时的化学平衡常数为9.
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为75%.
(3)800℃时,该反应的平衡常数为1,则该反应的△H< 0(填>,<,=)
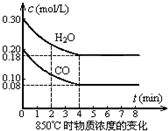
(4)改变起始条件,在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
t℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是D(单选),
表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度.
| A. |  易燃液体 | B. |  遇湿易燃物品 | C. |  氧化剂 | D. |  腐蚀品 |
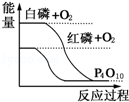 如图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
如图表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )| A. | 等质量的白磷与红磷充分燃烧,红磷放出的热量 | |
| B. | 红磷比白磷稳定 | |
| C. | 白磷转化为红磷是吸热反应 | |
| D. | 红磷比白磷更容易与氧气反应生成P4O10 |
 .
.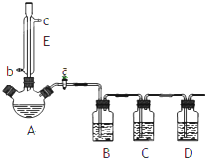 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.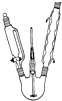 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下: