题目内容
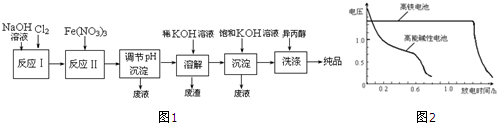
14.工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得:
BaSO4(s)+4C(s)$\stackrel{高温}{?}$4CO(g)+BaS(s)△H1=+571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\stackrel{高温}{?}$2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1 ②
(1)流程图中气体用过量的NaOH溶液吸收,得到一种钠盐.写出该盐发生水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)向0.1mol/L BaCl2溶液中加入一定量的AgNO3溶液和KBr溶液,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3,则Ksp(AgBr)=5.4×10-13.[已知:Ksp(AgCl)=2.0×10-10]
(3)反应2CO(g)$\stackrel{高温}{?}$C(s)+CO2(g)的△H=-172.5kJ•mol-1.
分析 (1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)当两种沉淀共存时,Ag+离子浓度相同,根据$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{c(Ag{\;}^{+})•c(B{r}^{-})}{c(Ag{\;}^{+})•c(C{l}^{-})}$,结合$\frac{c(B{r}^{-})}{c(C{l}^{-})}$和Ksp(AgCl)的值可计算出Ksp(AgBr)的值;
(3)利用盖斯定律,将②-①再除以2可得反应2CO(g)$\stackrel{高温}{?}$C(s)+CO2(g),据此计算反应热;
解答 解:(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-;
HS-+H2O?H2S+OH-,
故答案为:S2-+H2O?HS-+OH-\HS-+H2O?H2S+OH-;
(2)当两种沉淀共存时,Ag+离子浓度相同,根据$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{c(Ag{\;}^{+})•c(B{r}^{-})}{c(Ag{\;}^{+})•c(C{l}^{-})}$,有Ksp(AgBr)=$\frac{c(B{r}^{-})}{c(C{l}^{-})}$×Ksp(AgCl)=2.7×10-3×2.0×10-10=5.4×10-13,
故答案为:5.4×10-13;
(3)根据反应BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
利用盖斯定律,将②-①再除以2可得反应2CO(g)$\stackrel{高温}{?}$C(s)+CO2(g)△H=$\frac{226.2kJ•mol{\;}^{-1}-571.2kJ•mol{\;}^{-1}}{2}$=-172.5kJ•mol-1,
故答案为:-172.5.
点评 本题考查较为综合,题目具有一定难度,涉及盐类的水解、难溶电解质的溶解平衡、反应热的计算等问题,本题注意溶度积常数的利用.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
请根据实验步骤,回答下列问题:(已知:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr)
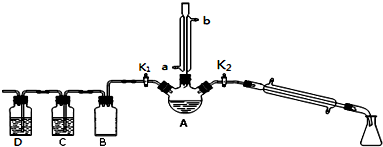
(1)关闭K1和K2,接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.竖直冷凝管的作用 是冷凝回流,使冷水从a(填a或b)处流入.
(2)写出A中发生反应的主要化学方程式:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭A处酒 精灯,在竖直冷凝管上方塞上塞子、打开K1,利用余热继续反应直至冷却,通过C、D装置检验
部分副产物,C、D中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水,
观察到D瓶中的现象是溶液褪色
(4)相关有机物的数据如下:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
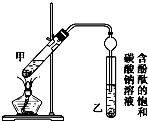 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
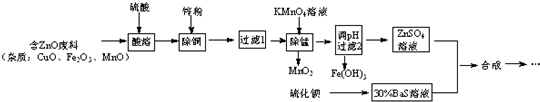
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有托盘天平.
(2)加入锌粉被还原的离子有Fe3+、Cu2+.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解.
(5)两种溶液合成立德粉,还需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是Cu2+、Mn2+及Fe3+没有除尽.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮;
②加入适量30% H2O2,使其充分反应;
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
④过滤得滤液.
(1)Cl2+2KI=2KCl+I2;
(2)2FeCl2+Cl2=2FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2,
(4)H2S+I2=S+2HI.
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
| A. | 1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA | |
| B. | 由2H和18O所组成的水11 g,其中所含的中子数为4NA | |
| C. | 常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA |