题目内容
13.火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
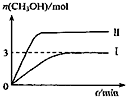
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇的反应的△H3<0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图2所示.试回答:0~10min内,氢气的平均反应速率为0.225mol/(L•min);该温度下,反应的平衡常数的值为$\frac{16}{3}$;第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时CH3OH(g)的体积分数增大(填变大、减少、不变).

(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.①室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡NH4++H2O?NH3•H2O+H+(用离子方程式表示).并计算该平衡的平衡常数表达式为$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{(2a+1{0}^{-9}-1{0}^{-5})}$(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算).
②在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)<c(NO3-)+c(OH-)(填写“>”“=”或“<”).
分析 (1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{1}{2}$(△H1+
△H2);
(2)①由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高平衡向逆反应进行;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,开始CO2的浓度为1mol/L,故容器的体积为$\frac{1mol}{1mol/L}$=1L,H2的起始浓度为$\frac{3mol}{1L}$=3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
根据v=$\frac{△c}{△t}$计算v(H2);平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为在原平衡的基础上增大压强,平衡正向移动;
(3)①溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,破坏水的电离平衡,溶液呈酸性,
室温下,a mol/L的(NH4)2SO4水溶液的pH=5,溶液中c(H+)=10-5mol/L,溶液中氢离子源于铵根离子水解及水的电离,故溶液中c(NH3•H2O)=c(H+)-c(OH-)=(10-5-10-9)mol/L,溶液中c(NH4+)=2amol/L-(10-5-10-9)mol/L=(2a+10-9-10-5 )mol/L,代入Kh=$\frac{c(N{H}_{3}•{H}_{2}O)×c({H}^{+})}{c(N{{H}_{4}}^{+})}$计算;
②根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-).
解答 解:(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{1}{2}$(△H1+
△H2)=-867kJ/mol,
反应热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,
故答案为:<;
②由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,开始CO2的浓度为1mol/L,故容器的体积为$\frac{1mol}{1mol/L}$=1L,H2的起始浓度为$\frac{3mol}{1L}$=3mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故0~10min内v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•min);
平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$;
第10min后,向该容器中再充入1mol CO2和3mol H2,等效为在原平衡的基础上增大压强,平衡正向移动,则再次达到平衡时CH3OH(g)的体积分数增大,
故答案为:0.225mol/(L•min);$\frac{16}{3}$;增大;
(3)①溶液中铵根离子水解:NH4++H2O?NH3•H2O+H+,破坏水的电离平衡,溶液呈酸性,
室温下,a mol/L的(NH4)2SO4水溶液的pH=5,溶液中c(H+)=10-5mol/L,溶液中氢离子源于铵根离子水解及水的电离,故溶液中c(NH3•H2O)=c(H+)-c(OH-)=(10-5-10-9)mol/L,溶液中c(NH4+)=2amol/L-(10-5-10-9)mol/L=(2a+10-9-10-5 )mol/L,则平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)×c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{(2a+1{0}^{-9}-1{0}^{-5})}$,
故答案为:NH4++H2O?NH3•H2O+H+;$\frac{1{0}^{-5}×(1{0}^{-5}-1{0}^{-9})}{(2a+1{0}^{-9}-1{0}^{-5})}$;
②根据电荷守恒:c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),则溶液中c(Na+)+c(H+)<c(NO3-)+c(OH-),故答案为:<.
点评 本题考查化学平衡计算与影响因素、热化学方程式、盐类水解等,培养了学生分析问题解决问题的能力,需要学生具备扎实的基础,难度中等.

| A. | 溴乙烷$\stackrel{NaOH/水}{→}$乙醇$\stackrel{浓硫酸}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| B. | 溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| C. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{HBr}{→}$溴乙烷$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 | |
| D. | 溴乙烷$\stackrel{氢氧化钠/醇}{→}$乙烯$\stackrel{Br_{2}}{→}$1,2-二溴乙烷 |
| A. | 曲线Ⅱ对应的条件改变是减小压强 | |
| B. | 若T2℃时,上述反应平衡常数为0.42,则T2<T1 | |
| C. | 在T1℃时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) | |
| D. | 在T1℃时,若起始时向容器中充入4.5molCO2、6mol H2,平衡时容器内压强P=$\frac{{P}_{1}}{2}$ |
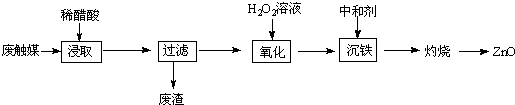
(1)浸取在三口烧瓶中进行,需给三口烧瓶加热并搅拌的目的是提高浸出速率和浸取率;浸出率随着浸取时间先增大后又减小,其原因是开始反应是加热搅拌加快浸出速率,但生成的醋酸锌被活性炭吸附,浸出率减小.
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是将吸附在活性炭孔内的醋酸锌全部释放出来.
(3)加入H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;沉铁需将溶液pH调整到约为5,最适宜的中和剂是bc(选填序号:a.石灰水 b.ZnO c.Zn.).
(4)高温灼烧时用到的硅酸盐质的仪器有酒精灯、坩埚和泥三角.
(5)某探究学习小组的同学拟利用废电池锌皮(主要成分为Zn,还含有少量的铁)制取氧化锌.如表列出了几种离子生成氢氧化物沉淀的pH:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
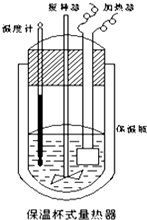 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 醋酸溶液 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 25.0 | 25.1 | 27.8 |
| 2 | 25.1 | 25.3 | 27.9 |
| 3 | 25.2 | 25.5 | 28.0 |
(2)CH3COOH的中和热的文献值为56.1KJ•mol-1,则请你分析在(1)中测得的实验值偏差可能的原因①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等.
(3)实验中NaOH过量的目的是使碱稍稍过量,为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度.
(4)CH3COOH的中和热与盐酸的中和热绝对值相比,HCl的较大,原因是CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热.
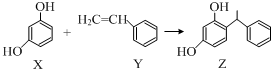
下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y可作加聚反应单体,X可作缩聚反应单体 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | X和Z均能与Na2CO3溶液反应放出CO2 |
