16.下列实验操作正确的是( )
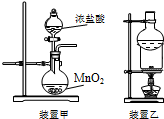

| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | c (Fe3+)=0.1 mol•L-1 的溶液中:Na+、NO${\;}_{3}^{-}$、SCN-、SO${\;}_{4}^{2-}$ | |
| C. | 使酚酞试液变红色的溶液中:Na+、Ba2+、I-、Cl- | |
| D. | 水电离的c (H+)=1×10-13mol•L-1的溶液中:K+、Na+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
14.短周期主族元素X、Y、Z、W原子序数依次增大,X与Z原子序数相差8,Y元素的焰色为黄色,Z元素的最高价为+6.下列叙述正确的是( )
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol•L-1 NaOH溶液中Na+的数目为0.1NA | |
| B. | 标准状况下,2.24 LCCl4中的分子数目为0.1NA | |
| C. | 0.1mol Na2O2与足量CO2反应转移的电子数目为0.1NA | |
| D. | 3.2gO2和O3的混合物含有的分子数目为0.1NA |
12.下列说法正确的是( )
| A. | 铝有较高熔点,可做耐火材料 | |
| B. | SO2能使溴水褪色,体现其漂白性 | |
| C. | 氨气是电解质,因为氨气的水溶液能导电 | |
| D. | 钠钾合金可用于快中子反应堆的热交换剂 |
11.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮离子(N3-)的结构示意图: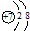 | |
| C. | 氨分子的电子式: | |
| D. | 硝基苯的结构简式: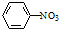 |
10.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 生活垃圾分类收集 | B. | 垃圾进行露天焚烧 | ||
| C. | 宣传“低碳”出行 | D. | 合理使用化肥农药 |
8.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | 相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| D. | Na2CO3和NaHCO3均不与NaOH溶液反应 |
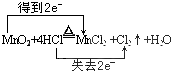
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是( )
0 172884 172892 172898 172902 172908 172910 172914 172920 172922 172928 172934 172938 172940 172944 172950 172952 172958 172962 172964 172968 172970 172974 172976 172978 172979 172980 172982 172983 172984 172986 172988 172992 172994 172998 173000 173004 173010 173012 173018 173022 173024 173028 173034 173040 173042 173048 173052 173054 173060 173064 173070 173078 203614
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 | |
| C. | 加入AgNO3溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
 .
.