题目内容
9.如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.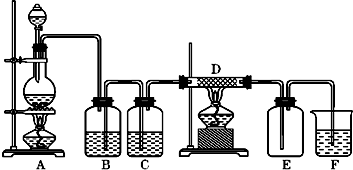
(1)写出A中方程式,并用双线桥法分析A中的电子转移情况
 .
.(2)上述装置中有一处错误,请指出是B处(用字母表示).
(3)通过B是为了除去HCl,在B中应加入饱和食盐水;
(4)写出F中发生反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O.
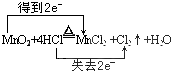
分析 (1)在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,1mol二氧化锰反应转移2mole-,据此用双线桥表示氧化还原反应电子转移;
(2)B处为气体的净化装置,为洗气瓶,应长进短出;
(3)依据浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水.
解答 解:(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,1mol二氧化锰反应转移2mole-,用双线桥法表示反应中电子转移的数目为: ;
;
故答案为: ;
;
(2)B处为气体的净化装置,为洗气瓶,应长进短出;
故选:B;
(3)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择饱和食盐水除去氯化氢,所以B中盛放的饱和食盐水;
故答案为:饱和食盐水;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备及性质检验,明确氯气制备原理和各装置作用是解题关键,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
17.下列溶液中NO3-的物质的量浓度最大的是( )
| A. | 500 mL 1 mol/L的HNO3溶液 | B. | 1 L 0.5 mol/L的Fe(NO3)3溶液 | ||
| C. | 100 mL 0.5 mol/L的Mg(NO3)2溶液 | D. | 300 mL 1 mol/L的Mg(NO3)2溶液 |
4.下列物质中属于电解质的是( )
| A. | C12H22O11(蔗糖) | B. | CO2 | C. | NaCl | D. | Al |
14.短周期主族元素X、Y、Z、W原子序数依次增大,X与Z原子序数相差8,Y元素的焰色为黄色,Z元素的最高价为+6.下列叙述正确的是( )
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |
1.下列设计的实验方案能达到实验目的是( )
| A. | 制备干燥的NH3:加热浓氨水,将生成的气体通过盛有浓硫酸的洗气瓶 | |
| B. | 提纯含有少量HCl的CO2:将混合气体依次通过盛有饱和碳酸钠溶液、浓硫酸的洗气瓶 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的烧瓶,先后置于冷水和热水中,观察烧瓶中气体颜色的变化 |
18.通过一步反应不能实现下列转化的是( )
| A. | Na2CO3→NaHCO3 | B. | Fe→FeCl2 | C. | NaCl→Na | D. | Al2O3→Al(OH)3 |
 .
.