20.下列除去杂质的实验方法正确的是( )
| A. | 除去CO2中少量O2:用点燃的方法 | |
| B. | 除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤 | |
| C. | 除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥 | |
| D. | 除去CO2中的少量HCl:通入NaOH溶液后,收集气体 |
19.铜镁合金1.52g完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol•L-1 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
18.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
| A. | 231.5mL | B. | 268.8mL | C. | 282.5mL | D. | 313.6mL |
17.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0,.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0,.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴适量H2O2,充分振荡后滴加KSCN. |
16.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中滴加KSCN溶液,再加入少量新制氯水,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
15.如图R、W、X、Y、Z为五种物质,若箭头表示能一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
| 选项 | R | W | X | Y | Z | 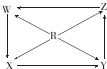 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
14.下列反应的离子方程式书写正确的是( )
| A. | 1.0 mol.L-l的NaAl02溶液和2.5 mol.L-l的盐酸等体积混合:2AlO${\;}_{2}^{-}$+5H+═Al(OH)3↓+Al3++H2O | |
| B. | 铜溶于0.5 mol.L-1的硝酸中:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 工业上将Cl2通人石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++Si${\;}_{4}^{2-}$═BaSO4↓+H2O |
13.NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )
| A. | 标准状况下,2.24 LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9g Na202晶体中所含的离子总数 | |
| D. | 0.1mol H2S和0.1 mol SO2混合后,体系中的硫原子数 |
12.设 NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4L CO完全燃烧生成CO2分子数为NA | |
| B. | 17g 氨气所含电子数为NA | |
| C. | 在常温、常压下,11.2L氯气所含的原子数目为NA | |
| D. | 32g氧气所含的原子数目为NA |
11.某气体的质量是同温、同压、同体积氢气质量的23倍,气体的相对分子质量是( )
0 172835 172843 172849 172853 172859 172861 172865 172871 172873 172879 172885 172889 172891 172895 172901 172903 172909 172913 172915 172919 172921 172925 172927 172929 172930 172931 172933 172934 172935 172937 172939 172943 172945 172949 172951 172955 172961 172963 172969 172973 172975 172979 172985 172991 172993 172999 173003 173005 173011 173015 173021 173029 203614
| A. | 23 | B. | 46 | C. | 69 | D. | 92 |