题目内容
13.NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )| A. | 标准状况下,2.24 LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9g Na202晶体中所含的离子总数 | |
| D. | 0.1mol H2S和0.1 mol SO2混合后,体系中的硫原子数 |
分析 A、求出氯气的物质的量,然后根据1mol氯气中含1mol共价键来分析;
B、HBr溶液中,除了HBr外,水也含氢原子;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析;
D、0.1mol H2S和0.1 mol SO2混合后发生反应,但反应过程中硫原子个数守恒.
解答 解:A、标况下2.24L氯气的物质的量为0.1mol,而1mol氯气中含1mol共价键,故0.1mol氯气中含0.1mol即0.1NA个共价键,故A错误;
B、HBr溶液中,除了HBr外,水也含氢原子,故溶液中的氢原子个数大于0.2NA个,故B错误;
C、3.9g过氧化钠的物质的量为0.05mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故0.05mol过氧化钠中含0.1mol钠离子和0.05mol过氧根,共0.15mol离子即0.15NA个,故C错误;
D、0.1mol H2S中含0.1mol硫原子,0.1 mol SO2中含0.1mol硫原子,虽然两者混合后发生反应,但反应过程中硫原子个数守恒,故体系中硫原子的物质的量仍为0.2mol即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
3.下列关于苯乙烯(结构简式为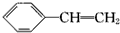 )可以发生的反应是( )
)可以发生的反应是( )
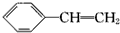 )可以发生的反应是( )
)可以发生的反应是( )| A. | 氧化反应 | B. | 加成反应 | ||
| C. | 能与酸性重铬酸钾反应 | D. | 加聚反应 | ||
| E. | 能使溴水褪色 |
4.下列电离方程式中,书写正确的是( )
| A. | Cu(OH)2=Cu2++2 OH- | B. | NH3•H2O?NH4++OH- | ||
| C. | HF=H++F- | D. | H3PO43?3H++PO43- |
8.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
| A. | 231.5mL | B. | 268.8mL | C. | 282.5mL | D. | 313.6mL |
3.在恒容密闭容器中,反应2A(g)?B(g)+C(g)△H<0达到化学平衡,下列说法正确的是( )
| A. | 升高温度,平衡常数增大 | |
| B. | 增大A的浓度,A的转化率不变 | |
| C. | 增大压强,化学平衡向正反应方向移动 | |
| D. | 增大B的浓度,A的转化率增大 |