题目内容
11.某气体的质量是同温、同压、同体积氢气质量的23倍,气体的相对分子质量是( )| A. | 23 | B. | 46 | C. | 69 | D. | 92 |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算相关物理量.
解答 解:同温、同压下气体的Vm相等,则同体积时物质的量相等,氢气的相对分子质量为2,某气体的质量是同温、同压、同体积氢气质量的23倍,则气体的相对分子质量是23×2=46,
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
1.在2L密闭容器中,把2mol X和2mol Y混合,发生如下反应:3X(g)+Y(g)═nP(g)+2Q(g),当反应经2min达到平衡,测得P的浓度为0.8mol/L,Q的浓度为0.4mol/L,则下列判断中,不正确的是( )
| A. | n=4 | |
| B. | X的转化率为60% | |
| C. | X的平衡浓度为0.4mol/L | |
| D. | 2 min内Y的平均速率为0.4mol/(L.min) |
16.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中滴加KSCN溶液,再加入少量新制氯水,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |

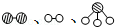 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.