题目内容
18.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )| A. | 231.5mL | B. | 268.8mL | C. | 282.5mL | D. | 313.6mL |
分析 发生反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的44.8mL气体可能为氧气,有可能是NO,设出混合气体中氨气体积为x、氧气体积为y,然后分别根据剩余气体为氧气、NO结合反应方程式列式计算即可.
解答 解:最终收集到44.8mL气体可能为氧气,有可能为NO,
当剩余气体为氧气时,发生反应有:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,设氧气总体积为y,氨气总体积为x,则:①x+y=448mL;由于氨气完全反应,则x体积氨气消耗氧气体积为:x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,生成的NO完全反应消耗氧气的体积为:x×$\frac{3}{4}$=$\frac{3}{4}$x,则:②$\frac{5}{4}$x+$\frac{3}{4}$x+44.8mL=y,联立①②解得:x=134.4mL、y=313.6mL,即:氧气体积为313.6mL;
当剩余的气体为NO时,则氧气、氨气完全反应,发生反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的44.8mL为NO,设原混合气体中氨气体积为x、氧气体积为y,则:③x+y=448mL,氨气完全反应消耗氧气体积为x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,其中转化成硝酸的NO体积为:x-44.8mL,此过程中消耗氧气体积为:(x-44.8mL)×$\frac{3}{4}$,消耗氧气总体积为:④$\frac{5}{4}$x+(x-44.8mL)×$\frac{3}{4}$=y,联立③④可得:x=160.5mL、y=287.5mL,即:原混合气体中氧气的总体积为287.5mL,
根据分析可知,原混合气体中氧气总体积可能为:313.6mL或287.5mL,
故选D.
点评 本题考查了混合物反应的计算,题目难度较大,明确剩余气体组成为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | Na2S溶液中通入适量H2S:S2-+H2S═2HS- | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H-═2Fe3++3H2O | |
| C. | 过量铁粉加入稀HNO3溶液中:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe2++2NO↑+4H2O | |
| D. | NaHSO3溶液显酸性的原因:HSO${\;}_{3}^{-}$+H2O?SO${\;}_{3}^{2-}$+H3O- |
| A. | 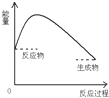 | B. | 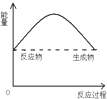 | C. |  | D. | 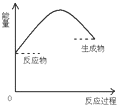 |
| A. | 标准状况下,2.24 LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9g Na202晶体中所含的离子总数 | |
| D. | 0.1mol H2S和0.1 mol SO2混合后,体系中的硫原子数 |
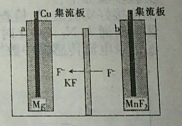
| A. | b为负极 | |
| B. | 该电池放电时,Cu集流板上Cu失电子 | |
| C. | 充电时,F-通过交换膜从b极区移向a极区 | |
| D. | 充电时,阳极的电极反应式为2MnF2+2F--2e-═2MnF3 |
| A. | 0.2 mol•L-1 的H2SO4溶液 | |
| B. | 0.2 mol•L-1 的HNO3溶液 | |
| C. | 0.2 mol•L-1 的H2SO4和HNO3混合溶液 | |
| D. | 1 mol•L-1 的H2SO4和HNO3混合溶液 |
 某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.