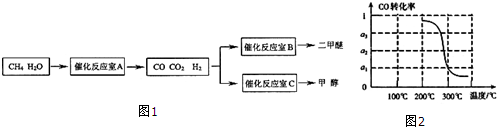
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)m=2,表中b<c(填“<”、“=”或“>”).
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
2.将4mol A气体和2mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经2s 后测得C的浓度为0.6mol•L-1 现有下列几种说法其中不正确的是( )
| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 2s时的压强是起始时的1.1倍 | |
| C. | 2s时物质A的转化率为30% | |
| D. | 2s时物质B的浓度为0.7mol/L |
1.已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
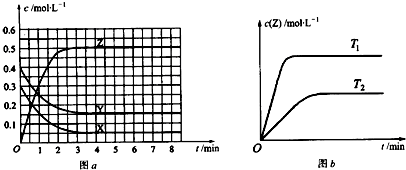

| A. | 该反应的化学方程式为:X+Y?2Z | |
| B. | 当反应速率大小关系为:v(X)=v(Y)=2v(Z)时,该反应达到平衡状态 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 该反应的正反应是放热反应 |
12.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1.0 L 1.0 mol•L-1 的NaAl02水溶液中含有的氧原子数为2 NA? | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 已知C2H4和C3H6混合物的质量为ag,所含原子总数为$\frac{a{N}_{A}}{14}$ |
11.下列离子方程式书写正确的是( )
0 172607 172615 172621 172625 172631 172633 172637 172643 172645 172651 172657 172661 172663 172667 172673 172675 172681 172685 172687 172691 172693 172697 172699 172701 172702 172703 172705 172706 172707 172709 172711 172715 172717 172721 172723 172727 172733 172735 172741 172745 172747 172751 172757 172763 172765 172771 172775 172777 172783 172787 172793 172801 203614
| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |