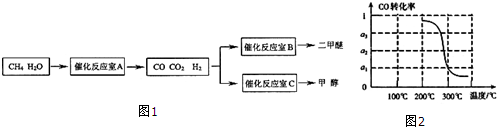
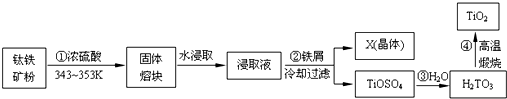
题目内容
1.已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )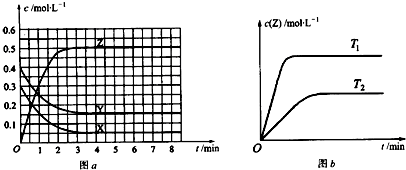
| A. | 该反应的化学方程式为:X+Y?2Z | |
| B. | 当反应速率大小关系为:v(X)=v(Y)=2v(Z)时,该反应达到平衡状态 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 该反应的正反应是放热反应 |
分析 A.由图a可知,X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不变,为可逆反应,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,化学计量数之比等于物质的量变化量之比;
B.可能反应到达平衡时,同种物质的正逆速率相等,不同物质的正逆速率之比等于其化学计量数之比;
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,结合转化率定义计算;
D.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动.
解答 解:A.由图a可知,X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不变,为可逆反应,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,化学计量数之比等于物质的量变化量之比,即X、Y、Z的化学计量数之比为0.25:0.25:0.5=1:1:2,则反应方程式为:X(g)+Y(g)?2Z(g),故A正确;
B.可能反应到达平衡时,同种物质的正逆速率相等,不同物质的正逆速率之比等于其化学计量数之比,选项中未指明正逆速率,不能确定是否到达平衡,故B错误;
C.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,故平衡时Y的转化率为$\frac{0.25mol/L}{0.4mol/L}$×100%=62.5%,故C错误;
D.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故D错误,
故选:A.
点评 本题考查化学平衡计算与影响因素、化学平衡图象问题等,难度中等,侧重考查学生读图获取信息能力,注意平衡图象中先拐先平数值大原则与定一议二原则.

| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
| A. | 四氯化碳分子的电子式: | B. | 对硝基甲苯的结构简式: | ||
| C. | 羟基的电子式: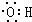 | D. | 乙醛的结构简式:CH3COH |

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
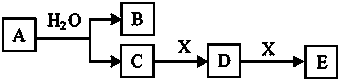
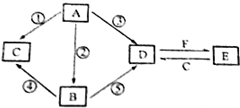 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略). ,C的俗名为火碱或烧碱;
,C的俗名为火碱或烧碱;