题目内容
2.将4mol A气体和2mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经2s 后测得C的浓度为0.6mol•L-1 现有下列几种说法其中不正确的是( )| A. | 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 2s时的压强是起始时的1.1倍 | |
| C. | 2s时物质A的转化率为30% | |
| D. | 2s时物质B的浓度为0.7mol/L |
分析 将4mol A气体和2mol B气体在2L 的容器中混合,并在一定条件下发生,若经2s 后测得C的浓度为0.6mol•L-1,则:
2A(g)+B(g)?2C(g)
起始量(mol/L):2 1 0
变化量(mol/L):0.6 0.3 0.6
2s时 (mol/L):1.4 0.7 0.6
A.根据v=$\frac{△c}{△t}$计算v(A);
B.恒温恒容下,压强之比等于物质的量之比;
C.A的转化率=$\frac{A的浓度变化量}{A的起始浓度}$×100%;
D.由上述分析可知,2s时B的浓度为0.7mol/L.
解答 解:将4mol A气体和2mol B气体在2L 的容器中混合,并在一定条件下发生,若经2s 后测得C的浓度为0.6mol•L-1,则:
2A(g)+B(g)?2C(g)
起始量(mol/L):2 1 0
变化量(mol/L):0.6 0.3 0.6
2s时 (mol/L):1.4 0.7 0.6
A.v(A)=$\frac{0.6mol/L}{2s}$=0.3 mol•L-1•s-1,故A正确;
B.恒温恒容下,压强之比等于物质的量之比,则2s时的压强是起始时的$\frac{(1.4+0.7+0.6)mol/L}{(2+1)mol/L}$=0.9倍,故B错误;
C.A的转化率=$\frac{0.6mol/L}{2mol/L}$×100%=30%,故C正确;
D.由上述分析可知,2s时B的浓度为0.7mol/L,故D正确,
故选:B.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意三段式解题法在化学平衡计算中应用.

| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |
| A. | 标况下将112mL氯气通入10mL 1mol•L-1的碘化亚铁溶液中:Cl2+2I-═2Cl-+I2 | |
| B. | 用FeS去除工厂废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| D. | 用醋酸除去水壶中的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 向橙色的K2Cr2O7溶液中加适量的浓硫酸充分振荡后橙色变深 | |
| B. | 向装有少量Na2S2O3溶液的试管中滴加适量稀硫酸充分振荡后无明显变化 | |
| C. | 向装有淀粉和KI溶液的试管中滴加适量H2SO4充分振荡后溶液变蓝 | |
| D. | 向装有少量H2O2溶液的试管中加适量CuSO4溶液充分振荡后产生大量气泡 |
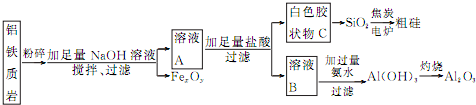
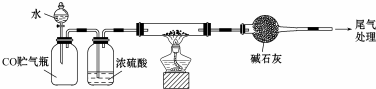
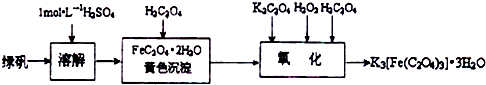
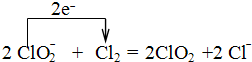 .
.