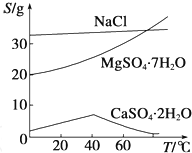
题目内容
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
分析 (1)20s时,△c(B)=0.12mol/L,△c(A)=(0.2-0.14)mol/L=0.06mol/L,浓度变化量之比等于化学计量数之比,则1:m=0.06:0.12,故m=2,根据40s时B的浓度变化量计算b,根据60s时A的浓度变化量计算c;
(2)100秒后若将容器的体积缩小至原来一半,瞬间浓度加倍,压强增大,平衡逆向移动;
(3)60s处于平衡状态,根据K=$\frac{{c}^{2}(B)}{c(A)}$计算平衡常数;
(4)在其他条件相同时,该反应的K值越大,说明向正反应进行程度越大,反应物转化率越大.
解答 解:(1)20s时,△c(B)=0.12mol/L,△c(A)=(0.2-0.14)mol/L=0.06mol/L,浓度变化量之比等于化学计量数之比,则1:m=0.06:0.12,故m=2,
40s时B的浓度变化量为0.2mol/L,则A的浓度变化量为0.1mol/L,故b=0.2-0.1=0.1,故60s是A的浓度变化量为(0.2-0.09)mol/L=0.11mol/L,则c=0.11×2=0.22,则b<c,
故答案为:2;<;
(2)100秒后若将容器的体积缩小至原来一半,瞬间浓度加倍,压强增大,平衡逆向移动,则平衡时A的浓度>0.09mol/L,
故答案为:>;
(3)60s处于平衡状态,由(1)中计算可知,平衡时B为0.22mol/L,平衡常数K=$\frac{{c}^{2}(B)}{c(A)}$=$\frac{0.2{2}^{2}}{0.09}$≈0.5,
故答案为:0.5;
(4)在其他条件相同时,该反应的K值越大,说明向正反应进行程度越大,反应物转化率越大,A与B的浓度之比越大,B的产量与A的转化率及A起始量有关,B的产量不一定增大,但B的产率增大,
故选:①②④.
点评 本题考查化学平衡计算与影响因素、平衡常数等,难度不大,(4)为易错点,学生容易将产量看作产率进行判断.

 阅读快车系列答案
阅读快车系列答案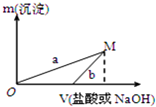 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
| A. | pH=3的NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等 | |
| B. | 25℃时将0.1 mol•L-1的HF加水不断稀释,$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$减小 | |
| C. | K2SO3溶液中加入少量的Ba(OH)2固体,溶液的pH增大,SO${\;}_{3}^{2-}$水解程度减小 | |
| D. | 因为AgBr比AgCl的KSP小,所以AgCl可以转化为AgBr,但AgBr无法转化为AgCl |
| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| A. | 前2s,N2O4的平均反应速率为0.005mol•L-1•s-1 | |
| B. | 平衡时,N2O4的转化率为50% | |
| C. | 平衡时,体系内NO2为0.04mol•L-1 | |
| D. | 在2s时,体系内压强为反应前的1.1倍 |