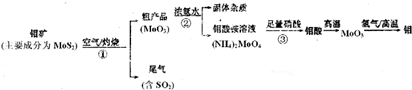
��Ŀ����
3����4L���ܱ������г���6mol A�����5mol B���壬��һ�������·������·�Ӧ��3A��g��+B��g��?2C��g��+xD��g������10s�ﵽƽ�⣬�������2molC��D��Ũ��Ϊ0.5mol•L-1�����㣺��1��x ��ֵΪ2
��2��B��ת����Ϊ20%
��3����Ӧ��10s��A�ķ�Ӧ����Ϊ0.075mol/��L•s��
��4����Ӧ���е�10sʱ������ͬ�¶��������ڻ�������ѹǿ�Ƿ�Ӧǰ��1��
��5�����¶��·�Ӧƽ�ⳣ��K=$\frac{4}{27}$��
���� ��4L���ܱ������г���6mol A�����5mol B���壬��10s�ﵽƽ�⣬�������2molC��D��Ũ��Ϊ0.5mol•L-1�����ɵ�DΪ4L��0.5mol/L=2mol������2mol��2mol=2��x����x=2����
3A��g��+B��g��?2C��g��+2D��g��
��ʼ����mol����6 5 0 0
�仯����mol����3 1 2 2
ƽ������mol����3 4 2 2
��1��������������֪x=2��
��2��B��ת����=$\frac{����B�����ʵ���}{B����ʼ���ʵ���}$��100%��
��3������v=$\frac{��c}{��t}$���㣻
��4�����º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ�
��5����Ӧǰ���������ʵ�����ȣ������ʵ�������Ũ�ȴ���K=$\frac{{c}^{2}��C����{c}^{2}��D��}{{c}^{3}��A����c��B��}$���㣮
��� �⣺��4L���ܱ������г���6mol A�����5mol B���壬��10s�ﵽƽ�⣬�������2molC��D��Ũ��Ϊ0.5mol•L-1�����ɵ�DΪ4L��0.5mol/L=2mol������2mol��2mol=2��x����x=2����
3A��g��+B��g��?2C��g��+2D��g��
��ʼ����mol����6 5 0 0
�仯����mol����3 1 2 2
ƽ������mol����3 4 2 2
��1��������������֪x=2���ʴ�Ϊ��2��
��2��B��ת����=$\frac{1mol}{5mol}$��100%=20%���ʴ�Ϊ��20%��
��3����Ӧ��10s��A�ķ�Ӧ����v��A��=$\frac{\frac{3mol}{4L}}{10s}$=0.075mol/��L•s�����ʴ�Ϊ��0.075mol/��L•s����
��4�����º����£�ѹǿ֮�ȵ������ʵ���֮�ȣ���Ӧǰ���������ʵ�����ȣ�ѹǿ���䣬ƽ��ʱ�����ڻ�������ѹǿ�Ƿ�Ӧǰ��1�����ʴ�Ϊ��1����
��5����Ӧǰ���������ʵ�����ȣ����������ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{{c}^{2}��C����{c}^{2}��D��}{{c}^{3}��A����c��B��}$=$\frac{{2}^{2}��{2}^{2}}{{3}^{3}��4}$=$\frac{4}{27}$���ʴ�Ϊ��$\frac{4}{27}$��
���� ���⿼�黯ѧƽ����㡢��Ӧ���ʼ��㡢ƽ�ⳣ�����㣬�ѶȲ���ע������ʽ���ⷨ�ڻ�ѧƽ������е�Ӧ�ã�

| A�� | ͨ������ʳ��ˮ��ȥCl2�е�HCl | |
| B�� | ͨ��NaOH��Һ��ȥCO2�е�HCl | |
| C�� | ͨ�����ȷ���ȥNa2CO3�����е�NaHCO3 | |
| D�� | ͨ��NaOH��Һ��ȥCO�л��е�CO2 |
| �� | �� | �� | ���������� | ���������� | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
 ������ȩ��CH3CHO�������ᣨCH3COOH�����Ҵ���CH3CH2OH����
������ȩ��CH3CHO�������ᣨCH3COOH�����Ҵ���CH3CH2OH���� ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ�����
ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ����� 2Z
2Z