18.选用适当的催化剂是改变反应速率常用的有效方法之一.某实验小组以H2O2分解为例,探究Fe3+和Cu2+对H2O2分解的催化效果.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
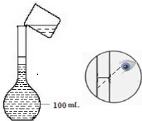
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
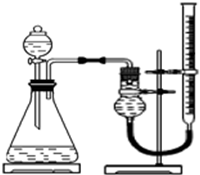
(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.

(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |

(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
17.铝电池性能优越,Al-AgO电池主要用于军用水下动力,其工作原理如图所示.下列有关Al-AgO电池的说法错误的是( )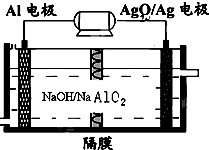

| A. | 正极反应中有Ag生成 | |
| B. | OH-通过隔膜从正极区移向负极区 | |
| C. | 消耗5.4g Al时,电路中转移0.6mol e- | |
| D. | 电池总反应为:2Al+3AgO=Al2O3+3Ag |
15.红热的木炭与浓硝酸共热产生的气体等分为①和②两份,第①份先通过适量蒸馏水,再导入少量石灰水;第②份直接通入少量石灰水.则石灰水的变化最可能为( )
| A. | ①不变浑浊,②变乳白色 | B. | ①变乳白色,②不变浑浊 | ||
| C. | ①变乳白色,②变乳白色 | D. | ①不变浑浊,②不变浑浊 |
13.用惰性电极电解2L0.5mol/L的硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 无法确定 |
12.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Fe2+、NO${\;}_{3}^{-}$、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
10.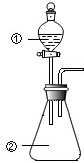 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
0 172599 172607 172613 172617 172623 172625 172629 172635 172637 172643 172649 172653 172655 172659 172665 172667 172673 172677 172679 172683 172685 172689 172691 172693 172694 172695 172697 172698 172699 172701 172703 172707 172709 172713 172715 172719 172725 172727 172733 172737 172739 172743 172749 172755 172757 172763 172767 172769 172775 172779 172785 172793 203614
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测中的现象 |
| A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
 .
.
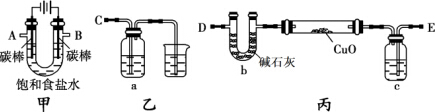 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.