题目内容
13.用惰性电极电解2L0.5mol/L的硝酸银溶液,当在电路中通过0.1mol电子后,调换正负极,电路中又通过了0.2mol电子,此时溶液pH值为(假设溶液体积不变)是( )| A. | 1 | B. | 2 | C. | 3 | D. | 无法确定 |
分析 调换正负极前后电极反应式如下:调换前:阴极:Ag+放电生成Ag,阳极发生氧化反应4OH--4e-═2H2O+O2↑,
调换后:阳极:4Ag-4e-=4Ag+(先),4OH--4e-=2H2O+O2↑(后);阴极:4Ag++4e-═4Ag,
故电路中转移的0.1mol电子后,只有0.1mol由OH-放电产生,即消耗的n(OH-)=0.1mol,生成n(Ag)=0.1mol,亦即溶液中积累的n(H+)=0.1 mol,调换正负极,电路中又通过了0.2mol电子,生成n(Ag)=0.1mol全部溶解,同时反应掉0.1mol氢氧根离子,亦即溶液中积累的n(H+)=0.1 mol,据此求算出c(H+)=0.2 mol,以此计算溶液的PH.
解答 解:2L0.5mol/L的硝酸银溶液含n(Ag+)=1mol,调换正负极前后电极反应式如下:调换前:阳极:4OH--4e-=2H2O+O2↑;阴极:4Ag++4e-═4Ag,
用惰性电极电解2L0.5mol/L的硝酸银溶液,分别是Ag+和OH-放电,通过0.1mole-,那么0.1molAg+放电,生成0.1molAg,同时 4OH--4e-=2H2O+O2↑,反应0.molOH-,得到0.1molH+,
调换后:阳极:4Ag-4e-=4Ag+(先),4OH--4e-=2H2O+O2↑(后);阴极:4Ag++4e-═4Ag,
调换正负极,那么通电前的0.1mole-,恰好是电镀银的过程,也就是第一个过程的银又溶解,在另一电极变为银,消耗0.1mole-,剩余0.1mole-,反应掉0.1mol氢氧根离子,还得到0.1molH+,故电路中转移的0.2mol电子中,所以总共得到0.2molH+,浓度为$\frac{0.2mol}{2L}$=0.1mol/L,PH=-lg(H+)=1.
故选A.
点评 本题考查电解原理,题目难度中等,本题注意分析调换正负极前后电极反应的变化,为解答该题的关键.

| A. | $\frac{50a}{13}$ mol | B. | $\frac{50a}{26}$mol | C. | $\frac{25a}{13}$mol | D. | $\frac{100a}{13}$mol |
 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
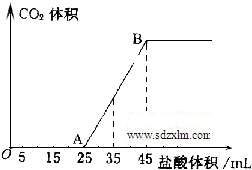
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1①已知:2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1;2H2(g)+O2(g)═2H2O(g)△H3=-484kJ•mol-1.则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
A)在上述三种温度中,曲线Z对应的温度是270℃.
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=4L2•mol-2.(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
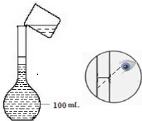
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
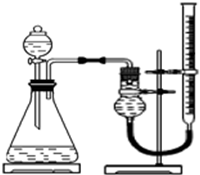
(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
| A. | 通过饱和食盐水除去Cl2中的HCl | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| D. | 通过NaOH溶液除去CO中混有的CO2 |
| A. | 8.00g | B. | 16.0g | C. | 25.0g | D. | 12.5g |
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO2 |
| C | NaOH | CH3COOH | CaF2 | CO | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |