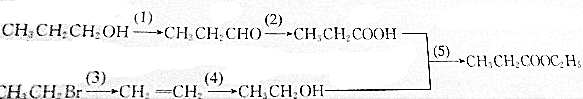题目内容
15.红热的木炭与浓硝酸共热产生的气体等分为①和②两份,第①份先通过适量蒸馏水,再导入少量石灰水;第②份直接通入少量石灰水.则石灰水的变化最可能为( )| A. | ①不变浑浊,②变乳白色 | B. | ①变乳白色,②不变浑浊 | ||
| C. | ①变乳白色,②变乳白色 | D. | ①不变浑浊,②不变浑浊 |
分析 红热的木炭与浓硝酸共热生成二氧化氮、二氧化碳;二氧化氮溶于水生成硝酸和一氧化氮,二氧化碳几乎不溶于水,但是可以使石灰水变浑浊,据此解答.
解答 解:①木炭与浓硝酸共热可以得到二氧化碳和二氧化氮两种气体,气体先导入适量蒸馏水中,二氧化氮溶于水,得到硝酸和一氧化氮,二氧化碳几乎不溶于水,剩余气体为二氧化碳和一氧化氮,再导入澄清石灰水中,二氧化碳可以使石灰水变浑浊,一氧化氮不溶于水;
②二氧化碳和二氧化氮两种气体,直接通入少量石灰石,二氧化氮溶于水,得到硝酸和一氧化氮,二氧化碳和氢氧化钙反应生成的碳酸钙会被硝酸溶解,不会产生沉淀;
故选:B.
点评 本题考查了氮的化合物的性质,熟悉硝酸、二氧化氮、一氧化氮和二氧化碳的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
5.在通风橱中进行下列实验:
下列说法中不正确的是( )
| 步骤 | 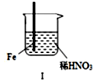 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 | |
| B. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| C. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
6.下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④分散系一定是混合物
⑤浊液均可用过滤的方法分离.
①酸性氧化物肯定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④分散系一定是混合物
⑤浊液均可用过滤的方法分离.
| A. | ①③ | B. | ④⑤ | C. | ②④ | D. | ③④ |
3.合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是( )
| A. | 金属焊接时可用NH4Cl溶液作除锈剂 | |
| B. | 配制FeSO4溶液时,加入一定量Fe粉 | |
| C. | 长期施用铵态氮肥会使土壤酸化 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有气泡产生 |
10.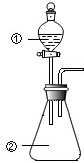 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测中的现象 |
| A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
5.下列反应的离子方程式正确的是( )
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 纯碱溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氢氧化铜溶于氢溴酸:Cu(OH)2+2H+═Cu2++2H2O |
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.