题目内容
18.选用适当的催化剂是改变反应速率常用的有效方法之一.某实验小组以H2O2分解为例,探究Fe3+和Cu2+对H2O2分解的催化效果.仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
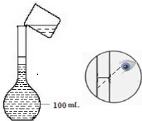
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
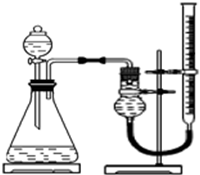
(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
分析 I.(1)求出所需的硫酸铜的物质的量,然后根据1mol胆矾~1mol硫酸铜来计算所需的胆矾的物质的量和质量;溶解固体时用烧杯和玻璃棒;
(2)定容时,开始直接向容量瓶中倒水,后来改用胶头滴管逐滴滴入;定容时应平视;
(3)定容时俯视液面,会导致溶液体积偏小;
II.根据实验目的是探究Fe3+和Cu2+对H2O2分解的催化效果,故根据控制变量的原则可知,应保持其它影响因素一致.且从实验装置可知,要通过测量生成相同体积的气体所需要的时间来判断分解速率的快慢.
将实验①②③做
(4)本实验是要通过测量生成相同体积的气体所需要的时间来判断分解速率的快慢,据此分析所需的计量工具;若气密性良好,则滴定管中的液面一段时间后不再下降;
(5)实验①④的不同是④中加入了SO42-,据此分析;
(6)实验②的目的是为了探究Cu2+对H2O2分解速率的影响,根据控制变量法来分析;
(7)实验③中选用的试剂M中应含Fe3+,还应保持其它影响因素一致,据此分析M;测得收集V mL O2所需时间m>n>p,所需时间越长,则催化效率越低,据此分析.
解答 解:I.(1)配制0.1mol/L100mL的硫酸铜溶液所需的硫酸铜的物质的量n=CV=0.1mol/L×0.1L=0.01mol,而1mol胆矾能提供1mol硫酸铜,故所需胆矾的物质的量为0.01mol,故所需的胆矾的质量m=nM=0.01mol×250g/mol=2.5g;溶解固体时用烧杯和玻璃棒.故答案为:2.5g,烧杯和玻璃棒;
(2)定容时,开始直接向容量瓶中倒水,后来改用胶头滴管逐滴滴入;定容时应平视,否则所配溶液的体积不准,故答案为:未用胶头滴管定容;定容时应平视液面;
(3)定容时俯视液面,会导致溶液体积偏小,则溶液浓度偏高,故答案为:偏高;
II.(4)本实验是要通过测量生成相同体积的气体所需要的时间来判断分解速率的快慢,故所需的计量工具还有秒表;检查装置的气密性时,要关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好,故答案为:秒表;关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好;
(5)实验①④的不同是④中引入了SO42-,故通过④和①的对比,可以排除SO42-对双氧水分解速率的影响,故答案为:排除SO42-对双氧水分解速率的影响;
(6)通过①和②的对比,实验②可以探究Cu2+对H2O2分解速率的影响,根据控制变量法,故应保持其他因素一致,故选用试剂的体积v1也应为5mL,故答案为:5;
(7)实验③中选用的试剂M中应含Fe3+,还应保持其它影响因素一致,而0.1mol/L CuSO4中Cu2+的浓度为0.1mol/L,则M中Fe3+的浓度也应为0.1mol/L,故应选用0.05mol/L Fe2(SO4)3溶液;测得收集V mL O2所需时间m>n>p,所需时间越长,则催化效率越低,故可以得出的结论为Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好,故答案为:0.05mol/L Fe2(SO4)3溶液;Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
点评 本题考查了配制一定物质的量浓度溶液的方法和探究催化剂对反应速率的影响,根据控制变量法来分析,综合性较强,难度较大.

| A. | 上述反应若有0.9molBr2反应,转移电子为1.5×6.02×1023个 | |
| B. | 反应后溶液的PH增大 | |
| C. | 若将NaBr和NaBrO3转变为Br2,需要在碱性条件下进行 | |
| D. | 该反应Na2CO3既是氧化剂又是还原剂 |
| A. | SiO2和NO2能与强碱溶液反应,都是酸性氧化物 | |
| B. | 不锈钢材料因含有铬、镍所以抗腐蚀性好 | |
| C. | 普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐 | |
| D. | MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应 |
| A. | 1 | B. | 2 | C. | 3 | D. | 无法确定 |
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
| A. | H2O | B. | NH3 | C. | HF | D. | HCl |
| A. | (b-2a)bmol•L-1 | B. | $\frac{(b-2a)}{2}$bmol•L-1 | C. | (2b-a)bmol•L-1 | D. | $\frac{(2b-a)}{2}$bmol•L-1 |
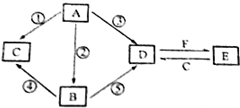 A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略).
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要的化工原料,也是实验室常用的药品,C、D在一定的条件下可以相互转化,F与A、B、C、D在一定条件下均可发生反应,它们的部分转化关系如图(部分反应物或生成物省略). ,C的俗名为火碱或烧碱;
,C的俗名为火碱或烧碱;