19.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
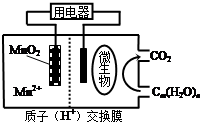

| A. | 分子组成为Cm (H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2 O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm (H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g |
18.下列说法正确的是( )
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
13.某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
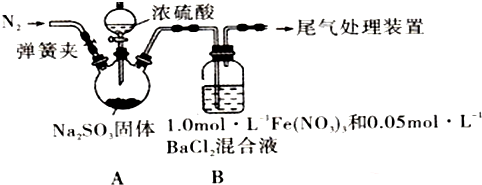
已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程SO2+2Fe3++2H2O=SO42-+2Fe2++4H+、3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.

已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
12.某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
为了鉴别上述化台物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
| 阳离子 | K+ Na+ Cu+ Al+ |
| 阴离子 | SO${\;}_{4}^{2-}$ HCO${\;}_{3}^{-}$ NO${\;}_{3}^{-}$ OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
10.铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O${\;}_{7}^{2-}$还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3•FeO)的复合氧化物($\stackrel{+3}{Cr}$x$\stackrel{+3}{Fe}$2-xO3•$\stackrel{+2}{Fe}$O).处理含1mol Cr2O${\;}_{7}^{2-}$废水至少需要加入a mol FeSO4•7H2O.下列结论正确的是( )
0 172564 172572 172578 172582 172588 172590 172594 172600 172602 172608 172614 172618 172620 172624 172630 172632 172638 172642 172644 172648 172650 172654 172656 172658 172659 172660 172662 172663 172664 172666 172668 172672 172674 172678 172680 172684 172690 172692 172698 172702 172704 172708 172714 172720 172722 172728 172732 172734 172740 172744 172750 172758 203614
| A. | x=0.5,a=10 | B. | x=1,a=5 | C. | x=2,a=10 | D. | x=0.5,a=8 |