题目内容
17.标准状况下,11.2升氧气含多少个氧气分子?分析 标况下,气体摩尔体积是22.4L/mol,根据N=nNA=$\frac{V}{{V}_{m}}{N}_{A}$计算分子数.
解答 解:标况下,气体摩尔体积是22.4L/mol,氧气分子数N=nNA=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{11.2L}{22.4L/mol}×{N}_{A}/mol$=0.5NA,
答:标准状况下,11.2升氧气含0.5NA个氧气分子.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量关系即可解答,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.实验室常用NaNO2和NH4Cl反应制取N2:NaNO2+NH4Cl═NaC1+N2↑+2H2O.下列说法正确的是( )
| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1molN2时转移6mol电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
8. 下列各组物质中,物质之间通过一步反应能实现图示变化的是( )
下列各组物质中,物质之间通过一步反应能实现图示变化的是( )
 下列各组物质中,物质之间通过一步反应能实现图示变化的是( )
下列各组物质中,物质之间通过一步反应能实现图示变化的是( )| 物质组编号 | a | b | c | d |
| ① | CO2 | CO | C | CaCO3 |
| ② | Na2CO3 | NaOH | Na2O2 | NaHCO3 |
| ③ | FeCl3 | FeCl2 | Fe | CuCl2 |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A. | ①②③ | B. | ②③④ | C. | ②④ | D. | ③④ |
5.化学反应的发生一般可通过现象加以判断.根据下列现象判断,其中没有新物质生成的是( )
①蛋白质溶液中加入硫酸铵后形成沉淀
②向氢氧化铁胶体中滴加盐酸产生沉淀;
③二氧化氮经加压冷凝成无色液体;
④溴水滴入裂化汽油中振荡褪色;
⑤硫酸铜粉末滴加少量水变蓝;
⑥活性炭除去水中的颜色和异味.
①蛋白质溶液中加入硫酸铵后形成沉淀
②向氢氧化铁胶体中滴加盐酸产生沉淀;
③二氧化氮经加压冷凝成无色液体;
④溴水滴入裂化汽油中振荡褪色;
⑤硫酸铜粉末滴加少量水变蓝;
⑥活性炭除去水中的颜色和异味.
| A. | ①②③ | B. | ②④⑥ | C. | ④⑤⑥ | D. | ①②⑥ |
12.某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
为了鉴别上述化台物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
| 阳离子 | K+ Na+ Cu+ Al+ |
| 阴离子 | SO${\;}_{4}^{2-}$ HCO${\;}_{3}^{-}$ NO${\;}_{3}^{-}$ OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、c为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)将含1 mol A的溶液与含l molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为Na2CO3.
(3)在A溶液中加入少量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+水解生成的氢氧化铝胶体能吸附水中的悬浮物净水
(5)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为466g.
9.某温度下,体积一定的密闭容器中进行如下反应X(g)+Y(g)?2Z(g)+W(s)△H>0下列叙述正确的是( )
| A. | 当容器中气体的平均摩尔质量不变时,反应达到了平衡 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 平衡后加入X,上述反应的△H增大 |
6.12g${\;}_{6}^{12}$C中所含的碳原子数目( )
| A. | 1 mol | B. | 0.5 mol | C. | 2 mol | D. | 无法计算 |
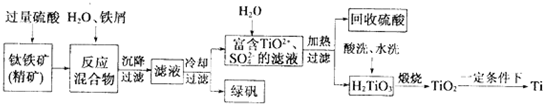
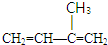 或
或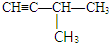 .
.