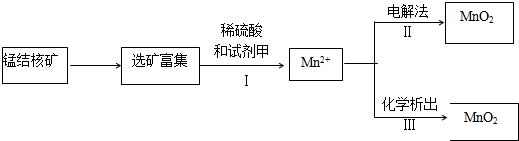
题目内容
13.某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示: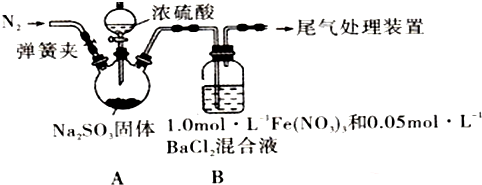
已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
分析 (1)亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(4)溶解的SO2也能使KMnO4溶液褪色;
(5)若证明在酸性条件下SO2与NO3-反应,可配制成酸性溶液,并替换装置B中的硝酸铁溶液,看是否有白色沉淀生成;
(6)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,发生氧化还原反应生成亚铁离子和硫酸根离子;立即又变为棕黄色,发生亚铁离子与硝酸根离子的氧化还原反应,生成铁离子.
解答 解:(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原;
(4)若SO2过量,溶解的SO2也能使KMnO4溶液褪色,故其结论错误,故答案为:否,可能SO2过量,溶解的SO2也能使KMnO4溶液褪色;
(5)若证明在酸性条件下SO2与NO3-反应,可配制成酸性溶液,①用NaNO3和盐酸配成pH=1,C(NO3-)=3 mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液,②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸看是否有白色沉淀生成,若装置B中有白色沉淀生成,猜想2成立,若装置B中无白色沉淀生成,猜想2不成立,
故答案为:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1,C(NO3-)=3 mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
点评 本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.

| A. | 淀粉和纤维素都属于纯净物 | |
| B. | 油脂是含热能很高的营养物质 | |
| C. | 人体摄入的微量元素越多越有利于健康 | |
| D. | 棉花、人造丝、蚕丝的主要成分都属于蛋白质 |
| A. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl | |
| B. | 比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | |
| C. | HCO${\;}_{3}^{-}$的电离方程式为:HCO${\;}_{3}^{-}$+H2O?CO${\;}_{3}^{2-}$+H3O+ | |
| D. | 次氯酸的结构式:H-Cl-O |
| A. | 加水的体积为vL | |
| B. | 加水的质量为mg | |
| C. | 0.5amol/L的氨水质量分数等于0.5b% | |
| D. | 0.5amol/L的氨水质量分数小于0.5b% |
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
| A. | H2 | B. | Cl2 | C. | H2O | D. | 空气 |