3.Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
(4)容器I中的反应达到平衡时所需的时间大于(填“大于”“小于”或等于)容器II中的.
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
2. 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
16.下列有关实验基本操作正确的是( )
0 172528 172536 172542 172546 172552 172554 172558 172564 172566 172572 172578 172582 172584 172588 172594 172596 172602 172606 172608 172612 172614 172618 172620 172622 172623 172624 172626 172627 172628 172630 172632 172636 172638 172642 172644 172648 172654 172656 172662 172666 172668 172672 172678 172684 172686 172692 172696 172698 172704 172708 172714 172722 203614
| A. | 实验室可以通过萃取、分液的方法将I2从其CCl4溶液中分离出来 | |
| B. | 从溶液中析出氯化钠晶体的常用方法是蒸发浓缩、冷却结晶 | |
| C. | 新配制的硫酸亚铁溶液中往往需加入少量铁锈 | |
| D. | 配制490mL 1mol•L-1的CuS04溶液需用500mL的容量瓶 |
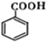 、
、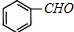 ;
;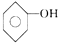 、
、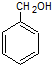 .
.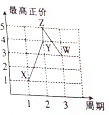 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
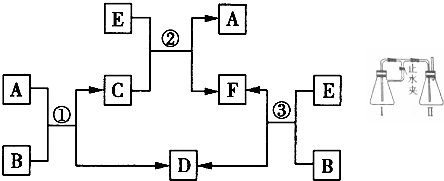
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 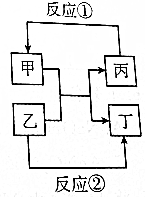 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题: