题目内容
2. 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
分析 A.由图可知,10min内甲容器中C的浓度变化量为1.5mol/L,根据v=$\frac{△c}{△t}$计算v(C),再利用速率之比等于化学计量数之比计算v(A);
B.比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动;
C.若x=1,反应前后气体的物质的量不变,缩小容器体积,不影响平衡移动;
D.乙中平衡时A的转化率为$\frac{1mol/L×0.5L×\frac{1}{2}}{1.5mol}$=$\frac{1}{6}$,丙中A的转化率为$\frac{2mol/L×1L×\frac{1}{2}}{6mol}$=$\frac{1}{6}$,丙中压强为乙中2倍,压强增大平衡不移动,故x=1,根据三段式计算甲中平衡时各组分的浓度,进而计算平衡常数,令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,再利用三段式表示出平衡时各组分的浓度,利用平衡常数列方程计算x的值,进而计算A的转化率.
解答 解:A.由图可知,10min内甲容器中C的浓度变化量为1.5mol/L,v(C)=$\frac{1.5mol/L}{10min}$=0.15mol/(L•min),速率之比等于化学计量数之比,所以v(A)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.15mol/(L•min)=0.075mol/(L•min),故A错误;
B.比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,故正反应为放热反应,故B错误;
C.若x=1,反应前后气体的物质的量不变,缩小容器体积,不影响平衡移动,故C错误;
D.乙中平衡时A的转化率为$\frac{1mol/L×0.5L×\frac{1}{2}}{1.5mol}$=$\frac{1}{6}$,丙中A的转化率为$\frac{2mol/L×1L×\frac{1}{2}}{6mol}$=$\frac{1}{6}$,丙中压强为乙中2倍,压强增大平衡不移动,故x=1,
A(g)+B(g)?2C(g)
开始(mol/L):3 1 0
变化(mol/L):0.75 0.75 1.5
平衡(mol/L):2.25 0.25 1.5
故T1℃,该反应的平衡常数为K=$\frac{1.{5}^{2}}{2.25×0.25}$=4
令T1℃,起始时甲容器中充入0.5molA、1.5molB,反应到达平衡时A的浓度变化量为x,则:
A(g)+B(g)?2C(g)
开始(mol/L):1 3 0
变化(mol/L):x x 2x
平衡(mol/L):1-x 3-x 2x
所以$\frac{(2x)^{2}}{(1-x)×(3-x)}$=4,解得:x=0.75
故A的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,故D正确;
故选:D.
点评 本题考查化学平衡计算与影响因素、化学反应速率计算、化学平衡图象,D选项为易错点、难点,判断x的值是解题的关键,难度中等.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 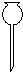 分液漏斗 | B. |  蒸发皿 | C. |  坩埚钳 | D. | 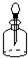 滴瓶 |
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 该反应的平衡常数表达式为:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此时正、逆反应速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,经10 min达到平衡,此时c(CH3OH)=0.04 mol/L | |
| D. | 10 min达到平衡时,反应速率v(CH3OH)=1.6 mol/(L•min) |
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别.
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:[石灰石]$\stackrel{①高温}{→}$[生石灰]$\stackrel{②加水}{→}$[石灰水]$\stackrel{③加Na_{2}CO_{3}溶液}{→}$[碳酸钙]
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO 分解反应;
②CaO+H2O═Ca(OH)2 化合反应;
③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应.
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石-→
你设计的方案的优点为:反应条件简单,易于操作,所得产品纯度高.
(5)检验牙膏中是否含有碳酸钙的实验方法是:取少量样品,加入稀盐酸,观察有无使澄清石灰水变浑浊的气体产生,若有,则含CaCO3,否则不含.
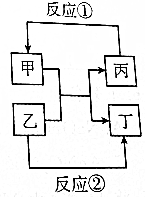 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题: