题目内容
16.下列有关实验基本操作正确的是( )| A. | 实验室可以通过萃取、分液的方法将I2从其CCl4溶液中分离出来 | |
| B. | 从溶液中析出氯化钠晶体的常用方法是蒸发浓缩、冷却结晶 | |
| C. | 新配制的硫酸亚铁溶液中往往需加入少量铁锈 | |
| D. | 配制490mL 1mol•L-1的CuS04溶液需用500mL的容量瓶 |
分析 A.I2溶解在CCl4溶液中不分层;
B.从溶液中析出氯化钠晶体,为可溶性固体与液体的分离;
C.亚铁离子易被氧化;
D.配制490mL 溶液,选择500mL容量瓶.
解答 解:A.I2溶解在CCl4溶液中不分层,不能利用萃取、分液分离,应选择蒸馏法,故A错误;
B.从溶液中析出氯化钠晶体,为可溶性固体与液体的分离,应蒸发结晶即可,不需要冷却结晶,故B错误;
C.亚铁离子易被氧化,则新配制的硫酸亚铁溶液中往往需加入少量铁锈,故C正确;
D.配制490mL 溶液,选择500mL容量瓶,则配制490mL 1mol•L-1的CuS04溶液需用500mL的容量瓶,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、溶液配制、氧化还原反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
6.根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O═2HI+H2SO4 2FeCl3+2HI═2FeCl2+2HCl+I2
3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
H2SO3+I2+H2O═2HI+H2SO4 2FeCl3+2HI═2FeCl2+2HCl+I2
3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
| A. | NO>FeCl2>H2SO3>HI | B. | HI>FeCl2>H2SO3>NO | ||
| C. | FeCl2>HI>H2SO3>NO | D. | H2SO3>HI>FeCl2>NO |
4.下列叙述中,正确的是( )
| A. | 同物质的量的NaCl和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96g | |
| C. | 阿伏伽德罗常数约为6.02×1023mol-1 | |
| D. | 1摩尔氧气的质量等于NA个O2分子的相对分子质量 |
9.下列符合实际并用于工业生产的是( )
| A. | 电解氯化钠水溶液来制金属钠 | B. | 氢气和氯气混合后光照制氯化氢 | ||
| C. | 金属钠在氯气中燃烧制氯化钠 | D. | 氯气和石灰乳作用制漂白粉 |
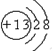 ,由A和B形成的含有非极性键的离子化合物的电子式是
,由A和B形成的含有非极性键的离子化合物的电子式是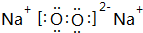 ;
;