题目内容
13.把1mL浓H2SO4稀释成1000mL,取稀释后的溶液200mL,用0.2mol/L的NaOH溶液滴定值终点,用去NaOH溶液22.4mL,试着计算稀释前浓硫酸的物质的量浓度?分析 发生2NaOH+H2SO4=Na2SO4+2H2O,n(H2SO4)=$\frac{1}{2}$n(NaOH),结合稀释前后溶质的物质的量不变计算.
解答 解:发生2NaOH+H2SO4=Na2SO4+2H2O,n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.2mol/L×0.0224L=0.00224mol,
则稀释后硫酸的浓度为=$\frac{0.00224mol}{0.2L}$=0.0112mol/L,
由溶液的均一性可知,1000mL溶液的浓度为0.0112mol/L,
稀释前后溶质的物质的量不变,设稀释前浓硫酸的物质的量浓度为x,则1mL×10-3L×x=1L×0.0112mol/L,
解得x=11.2mol/L,
答:稀释前浓硫酸的物质的量浓度为11.2mol/L.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量为中心的计算公式及稀释计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
4.常温下,醋酸与氨水等体积混合后,溶液的pH=7,则下列离子浓度的比较正确的是( )
| A. | c(CH3COO-)>c(NH4+)>c(H+)=c(OH-) | B. | c(NH4+)>c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) | D. | c (CH3COO-)>c(NH4+)>c(H+)>c(OH-) |
8. A、B、C三种强电解质,它们在水中电离出的离子如表所示:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间的关系如图2.据此回答下列问题:
(1)M为电源的负极(填“正”或“负”),e电极上产生的气体体积为2.8L(标准状况下).
(2)e电极上发生的电极反应为2H++2e-=H2↑.
 A、B、C三种强电解质,它们在水中电离出的离子如表所示:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
(1)M为电源的负极(填“正”或“负”),e电极上产生的气体体积为2.8L(标准状况下).
(2)e电极上发生的电极反应为2H++2e-=H2↑.
6.下列说法中正确的是( )
| A. | 烧菜用过的铁锅,经放置因发生氧化还原反应常出现红棕色斑迹 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量的MgSO4 | |
| C. | 蒸馏时温度计时用来测定蒸馏烧瓶中液体的温度 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
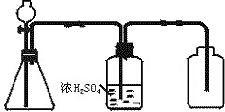 如图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是①(填代号).
如图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是①(填代号).