题目内容
15.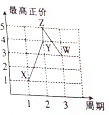 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. (1)V元素位于元素周期表中第二周期VIA族.
(2)由上述元素中所有非金属元素组成且既含离子键又含共价键的化合物的化学式为NH4NO3、CH3COO(NH4)2(任写两种,其中一种是无机物,一种是有机物);由上述元素中所有非金属元素组成且只含共价键的物质.可能属于BC(填字母).
A.铵盐 B.油脂 C.硝基苯或其同系物
(3)W(YX3)3与Z的简单氢化物共热可制得WZ,写出反应的化学方程式:Al(CH3)3+NH3$\frac{\underline{\;\;△\;\;}}{\;}$AlN+3CH4
(4)由上述元素中的两种元素组成的某化合物N中含有18个电子.该物质的水溶液是一种常见的消毒剂.按要求写出下列化学方程式(是离子反应的写离子方程式)
①N既是氧化剂又是还原剂:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②酸化的N溶液可使淀粉-KI试纸变蓝:2H++H2O2+2I-=I2+2H2O;
③N使酸性高锰酸钾溶液褪色:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑.
分析 X、Y、Z、W、V是五种短周期主族元素,V元素的原子序数是下一周期同族元素的原子序数的一半,则V是O元素;部分元素的周期序数与最高正价的关系如图所示,X、Y、Z、W元素最高价分别为1、4、5、3,根据元素所在周期知,X是H元素、Y是C元素、Z是N元素、W是Al元素,
(1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;
(2)由上述元素中所有非金属元素组成且既含离子键又含共价键的化合物有硝酸铵、乙酸铵;由上述元素中所有非金属元素组成且只含共价键的物质中有硝基苯及其同系物、油脂等;
(3)Al(CH3)3与N的简单氢化物氨气共热可制得AlN,根据反应物和生成物及反应条件书写方程式;
(4)由上述元素中的两种元素组成的某化合物N中含有18个电子,该物质的水溶液是一种常见的消毒剂,N是双氧水;①双氧水分解时双氧水既是氧化剂又是还原剂;
②酸化的N溶液可使淀粉-KI试纸变蓝,双氧水能氧化碘离子生成碘单质;
③双氧水能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:X、Y、Z、W、V是五种短周期主族元素,V元素的原子序数是下一周期同族元素的原子序数的一半,则V是O元素;部分元素的周期序数与最高正价的关系如图所示,X、Y、Z、W元素最高价分别为1、4、5、3,根据元素所在周期知,X是H元素、Y是C元素、Z是N元素、W是Al元素,
(1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,O原子核外有2个电子层、最外层电子数为6,所以位于第二周期第VIA族,故答案为:VIA;
(2)由上述元素中所有非金属元素组成且既含离子键又含共价键的化合物有硝酸铵、乙酸铵,化学式为NH4NO3、CH3COO(NH4)2;由上述元素中所有非金属元素组成且只含共价键的物质中有硝基苯及其同系物、油脂等,故答案为:NH4NO3、CH3COO(NH4)2;BC;
(3)Al(CH3)3与N的简单氢化物氨气共热可制得AlN,根据反应物和生成物及反应条件书写方程式为,故答案为:Al(CH3)3+NH3$\frac{\underline{\;\;△\;\;}}{\;}$AlN+3CH4,
故答案为:Al(CH3)3+NH3$\frac{\underline{\;\;△\;\;}}{\;}$AlN+3CH4;
(4)由上述元素中的两种元素组成的某化合物N中含有18个电子,该物质的水溶液是一种常见的消毒剂,N是双氧水;①双氧水分解时双氧水既是氧化剂又是还原剂,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②酸化的N溶液可使淀粉-KI试纸变蓝,双氧水能氧化碘离子生成碘单质,离子反应方程式为2H++H2O2+2I-=I2+2H2O,故答案为:2H++H2O2+2I-=I2+2H2O;
③双氧水能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑.
点评 本题考查位置结构性质相互关系及应用,为高频考点,正确判断元素是解本题关键,熟悉常见元素化合物性质,会根据双氧水中O元素化合价确定双氧水性质,题目难度不大.

| A. | 100mL 0.5mol/L MgCl2溶液 | B. | 200mL 0.25mol/L CaCl2溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 250mL 0.2mol/L HCl溶液 |
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在下图装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O

(1)图1反应装置中加入沸石的目的是防止暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.
(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
| A. | 标准状况下6.72L NH3的质量约为5.1g | |
| B. | 10g D216O分子中所含中子数为4NA | |
| C. | 2.3g金属钠全部变成钠离子失去的电子数目为0.2NA | |
| D. | 150mL1mol/L氯化钠溶液与50mL1mol/L AlCl3溶液中氯离子的物质的量浓度相等 |
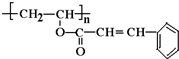
 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
. 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示: