题目内容
3.Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
分析 Ⅰ.(1)T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L):0.2 0.3 0 0
变化量(mol/L):0.12 0.12 0.12 0.12
平衡量(mol/L):0.08 0.18 0.12 0.12
代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
(2)已知:①.CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②.CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g);
(3)氨气发生氧化反应,失去电子,碱性条件下生成氮气与水;
Ⅱ.(4)相同温度下,浓度越大,反应速率越快,到达平衡的时间越短;
(5)容器Ⅱ中平衡等效为在容器I中平衡的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,甲醇的转化率相同;
(6)A.反应前后气体的物质的量不变,恒温恒容下,容器中压强始终不变;
B.平衡时各组分的浓度保持不变;
C.混合气体总质量不变,容器容积不变,混合气体的密度始终不变;
D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1,而生成2分子甲醇需要1分子甲醚,说明甲醚的生成速率与消耗速率相等;
(7)已知:反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
根据盖斯定律,②-①×2可得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=(2m-n)kJ•mol-1,
由表中数据,对比I、Ⅲ可知,降低温度平衡时甲醚的物质的量增大,说明降低温度平衡正向移动,正反应为放热反应.
解答 解:Ⅰ.(1)T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L):0.2 0.3 0 0
变化量(mol/L):0.12 0.12 0.12 0.12
平衡量(mol/L):0.08 0.18 0.12 0.12
平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.18}$=1,
故答案为:1;
(2)已知:①.CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②.CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(3)氨气发生氧化反应,失去电子,碱性条件下生成氮气与水,电极反应为为:2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
Ⅱ.(4)相同温度下,Ⅱ中浓度较大,反应速率越快,到达平衡的时间更短,故答案为:大于;
(5)容器Ⅱ中平衡等效为在容器I中平衡的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,甲醇的转化率相同,故a=0.08×2=0.16,
故答案为:0.16;
(6)A.反应前后气体的物质的量不变,恒温恒容下,容器中压强始终不变,不能说明到达平衡,故A错误;
B.混合气体中c(CH3OCH3) 不变,说明到达平衡,故B正确;
C.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故C错误;
D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1,而生成2分子甲醇需要1分子甲醚,说明甲醚的生成速率与消耗速率相等,反应到达平衡,故D正确,
故选:BD;
(7)已知:反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
根据盖斯定律,②-①×2可得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=(2m-n)kJ•mol-1,
由表中数据,对比I、Ⅲ可知,降低温度平衡时甲醚的物质的量增大,说明降低温度平衡正向移动,正反应为放热反应,即2m-n<0,则n>2m,
故选:A.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、热化学方程式、原电池等,题目比较综合,是对学生综合能力的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 容量瓶 | B. | 坩埚 | C. | 胶头滴管 | D. | 量筒 |
| A. |  | B. |  | C. |  | D. |  |
 A、B、C三种强电解质,它们在水中电离出的离子如表所示:
A、B、C三种强电解质,它们在水中电离出的离子如表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
(1)M为电源的负极(填“正”或“负”),e电极上产生的气体体积为2.8L(标准状况下).
(2)e电极上发生的电极反应为2H++2e-=H2↑.
| A. | 铜与硝酸银溶液反应 Cu+Ag+═Cu2++Ag | |
| B. | CH3COOH溶液与NaOH溶液反应 H++OH-═H2O | |
| C. | 碳酸镁与稀H2SO4反应 MgCO3+2H+═Mg2++H2O+CO2↑ | |
| D. | 石灰乳与稀盐酸反应 H++OH-═H2O |
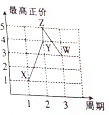 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 
 .
.