18.在20℃时的密闭容器中,加入0.1mol/L的N2O4,经过一段时间后,测定反应体系中各物质的浓度,数据如表.
请根据反应的化学方程式N2O4?2NO2分析:
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c(NO2) mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
15.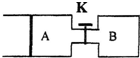 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
下列说法不正确的是( )
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.下列说法不正确的是( )
| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
14.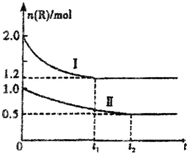 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )| A. | 将甲升温,可使甲和乙中各物质的体积分数达到相同 | |
| B. | x=2,且M、N中仅有一种为气态 | |
| C. | 曲线II为甲中R的物质的量一时间图象 | |
| D. | 其他条件不变时,向乙中再加入1mol M、1molN,达到新平衡时,则有1.0mol<n(R)<1.2 mol |
13.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理:
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
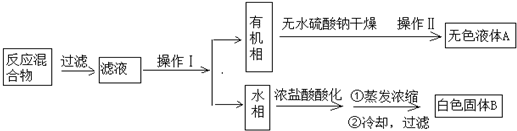
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液,移取25.00mL溶液,与一定量KOH溶液恰好完全反应,消耗KOH的物质的量为2.40×10-3 mol.产品中苯甲酸的质量分数为96%.
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |
12. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按以下步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、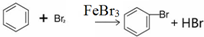 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
0 172500 172508 172514 172518 172524 172526 172530 172536 172538 172544 172550 172554 172556 172560 172566 172568 172574 172578 172580 172584 172586 172590 172592 172594 172595 172596 172598 172599 172600 172602 172604 172608 172610 172614 172616 172620 172626 172628 172634 172638 172640 172644 172650 172656 172658 172664 172668 172670 172676 172680 172686 172694 203614
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、
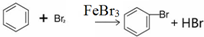 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
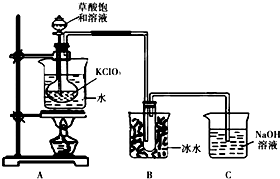 ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)