题目内容
17.在4L体积不变的密闭容器中充入6molA气体和5molB气体,发生反应:3A (g)+B (g)?2C (g)+x D (g),2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol/L,求:(1)x的值.
(2)2分钟时用A物质表示的反应速率
(3)达到平衡状态时B的转化率.
分析 (1)生成2molC的同时生成D为4L×0.25mol/L=1mol,物质的量之比等于化学计量数之比;
(2)由方程式可知,消耗的A为3mol,再根据v=$\frac{△c}{△t}$计算v(A);
(3)由方程式可知,消耗的B为1mol,B的转化率=$\frac{反应的B的物质的量}{B的起始物质的量}$×100%.
解答 解:(1)生成2molC的同时生成D为:4L×0.25mol/L=1mol,则2mol:1mol=2:x,所以x=1,
答:x的值为1;
(2)消耗的A为2mol×$\frac{3}{2}$=3mol,2分钟时用A表示的反应速率为:$\frac{\frac{3mol}{4L}}{2min}$=0.375mol/(L.min),
答:2分钟时用A表示的反应速率为0.375mol/(L.min);
(3)消耗的B为2mol×$\frac{1}{2}$=1mol,达到平衡时,B的转化率为:$\frac{1mol}{5mol}$×100%=20%,
答:达到平衡时,B的转化率为20%.
点评 本题考查化学平衡计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
19.医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的( )
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
5.卤代烃是有机合成的重要中间体,某化学兴趣小组的同学查阅资料发现:加热l-丁醇、浓H2SO4和溴化钠混合物可以制备1-溴丁烷.
发生反应:CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O.还会有烯、醚等副产物生成.反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:
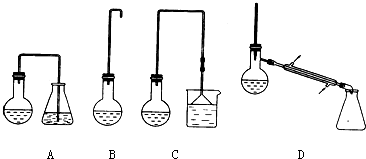
(1)制备1-溴丁烷的装置应选用上图中的C(填序号).反应加热时的温度不宜超过100℃,理由是防止1-溴丁烷因气化而逸出,影响产率且温度太高,浓硫酸氧化性增强,可能氧化溴化氢.
(2)制备操作中,加入的浓硫酸和溴化钠的作用是二者反应生成HBr.
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是D(填序号);该操作应控制的温度(t)范围是101.6℃≤t<117.25℃.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl.
发生反应:CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O.还会有烯、醚等副产物生成.反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:

| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(2)制备操作中,加入的浓硫酸和溴化钠的作用是二者反应生成HBr.
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是D(填序号);该操作应控制的温度(t)范围是101.6℃≤t<117.25℃.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl.
12. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按以下步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、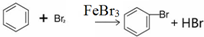 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、
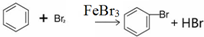 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
2.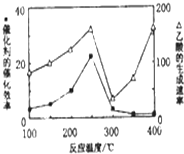 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
①t min内CO2的平均反应速率为$\frac{1}{t}$mol•L-1•min-1.此温度下该反应的平衡常数K=64
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4(难溶于水)为催化剂,可以将CO2和CH4直接氧化成乙酸.
①不同温度下催化剂的催化效率与乙酸的生成速率如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度等.(答一条即可)
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3 Cu2Al2O4+32 H++2 NO3-=6 Cu2++6 Al3++2 NO↑+16 H2O.
6.向浓度均为1mol/L的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸,边加边振荡在整个过程中不可能发生的离子反应是( )
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
7.实验室中,要使明矾溶液中的Al3+全部沉淀出 来,适宜用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 盐酸 | D. | Ba(OH)2溶液 |