题目内容
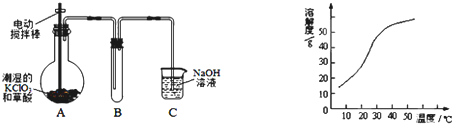
12. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、
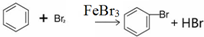 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
分析 本题是利用苯和液溴在三溴化铁作催化剂的条件下,在三颈烧瓶内发生取代反应制备溴苯,涉及了反应原理的考查,反应过程中为防止液溴和苯的挥发,提高原料利用率,用冷凝管进行冷凝回流,同时吸收生成的HBr气体,防污染;反应后的混合物通过过滤除去多余的铁粉,然后用氢氧化钠溶液洗去没有反应的溴及生成的HBr,然后通过分液、蒸馏进行分离提纯;
(1)反应在三颈烧瓶内进行,苯的卤代反应是放热的,用冷凝管对挥发出的蒸汽进行冷凝,冷却水的方向与汽流方向相反,尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(2)溴苯中含有溴,加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,据此解答;
(3)由分离操作可知,分离出的粗溴苯中含有未反应的苯,分离互溶的液体,根据沸点不同,利用蒸馏的方法进行分离.
解答 解:(1)在三颈烧瓶内发生的反应是2Fe+3Br2═2FeBr3 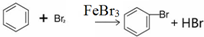 ,反应放热,且苯与液溴易挥发,发提高原料的利用率,用冷凝管冷却蒸汽并回流到三颈烧瓶内,冷却水的流向是低进高出,尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,故答案为:2Fe+3Br2═2FeBr3
,反应放热,且苯与液溴易挥发,发提高原料的利用率,用冷凝管冷却蒸汽并回流到三颈烧瓶内,冷却水的流向是低进高出,尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,故答案为:2Fe+3Br2═2FeBr3 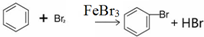 ;三颈烧瓶;吸收HBr气体;下;
;三颈烧瓶;吸收HBr气体;下;
(2)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中.然后加干燥剂,无水氯化钙能吸收水分,干燥溴苯,故答案为:除去HBr和未反应的Br2;吸收其中的水分;
(3)反应后得到的溴苯中溶有少量未反应的苯.利用沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯,故答案为:苯;C.
点评 本题主要考查了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案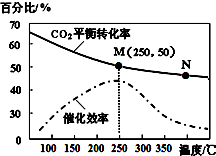 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
| A. | 40% | B. | 50% | C. | 80% | D. | 100% |
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.