题目内容
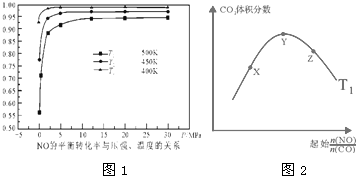
14.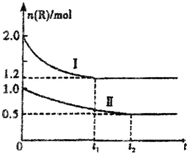 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )| A. | 将甲升温,可使甲和乙中各物质的体积分数达到相同 | |
| B. | x=2,且M、N中仅有一种为气态 | |
| C. | 曲线II为甲中R的物质的量一时间图象 | |
| D. | 其他条件不变时,向乙中再加入1mol M、1molN,达到新平衡时,则有1.0mol<n(R)<1.2 mol |
分析 A.由R的始量可知,曲线I表示甲中R变化,曲线Ⅱ表示乙中R变化,平衡时甲中R的转化率为$\frac{(2-1.2)mol}{2mol}$×100%=40%,乙中R的转化率为$\frac{(1-0.5)mol}{1mol}$=50%,乙中R的转化率较大,正反应为吸热反应,将甲升温平衡正向移动;
B.甲中平衡等效在乙基础压强增大一倍,压强增大后R的转化率减小,说明增大压强平衡逆向移动,逆反应为气体物质的量减小的反应,故x=1,且M、N均为气态;
C.根据A分析可知,曲线Ⅱ表示乙中R变化;
D.其他条件不变时,向乙中再加入1mol M、1molN,等效为开始加入2molR,恒温恒容下与甲中平衡为等效平衡,平衡时相同物质物质的量相等.
解答 解:A.由R的始量可知,曲线I表示甲中R变化,曲线Ⅱ表示乙中R变化,平衡时甲中R的转化率为$\frac{(2-1.2)mol}{2mol}$×100%=40%,乙中R的转化率为$\frac{(1-0.5)mol}{1mol}$=50%,乙中R的转化率较大,正反应为吸热反应,将甲升温平衡正向移动,可以时R的转化率增大,故A正确;
B.甲中平衡等效在乙基础压强增大一倍,压强增大后R的转化率减小,说明增大压强平衡逆向移动,逆反应为气体物质的量减小的反应,故x=1,且M、N均为气态,故B错误;
C.由R的始量可知,曲线I表示甲中R变化,曲线Ⅱ表示乙中R变化,故C错误;
D.其他条件不变时,向乙中再加入1mol M、1molN,等效为开始加入2molR,恒温恒容下与甲中平衡为等效平衡,平衡时相同物质物质的量相等,则达到新平衡时,则有n(R)=1.2 mol,故D错误,
故选:A.
点评 本题考查化学平衡计算与影响因素,关键是根据图象转化率确定x与M、N的状态,注意等效思想应用,难度中等.

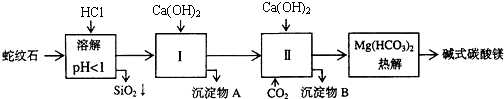
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2(填写物质化学式).
(5)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数升高(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于84).
| A. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 | |
| B. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| C. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| D. | SO2具有漂白性,能使紫色KMnO4溶液褪色 |
| A. | 32g氧气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有个水分子NA | |
| C. | 常温常压下,4g氦气所含原子数目为NA | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |