12.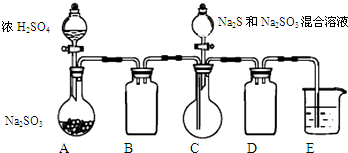 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
①步骤II中加入的试剂可以是B(填序号).
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
9.下列各原子或离子的基态电子排列式错误的是( )
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
4.一定温度下,10mL0.4mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表:下列叙述不正确的是(溶液体积变化忽略不计)( )
0 172474 172482 172488 172492 172498 172500 172504 172510 172512 172518 172524 172528 172530 172534 172540 172542 172548 172552 172554 172558 172560 172564 172566 172568 172569 172570 172572 172573 172574 172576 172578 172582 172584 172588 172590 172594 172600 172602 172608 172612 172614 172618 172624 172630 172632 172638 172642 172644 172650 172654 172660 172668 203614
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |



 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题: