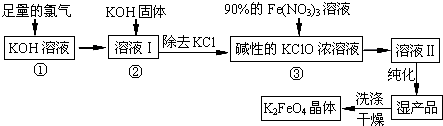
题目内容
12.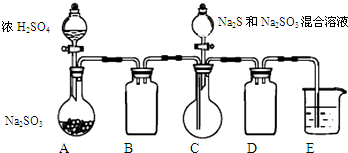 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
分析 (1)根据实验流程分析可知,实验最后有二氧化硫或硫化氢等尾气,会污染空气,要用氢氧化钠溶液吸收;
(2)根据反应Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)、2H2S(aq)+SO2(g)═3S(s)+2H2O(l)、S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)可知,Na2S和Na2SO3反应的总方程式为2Na2S+3SO2+Na2SO3=3Na2S2O3,据此计算;
(3)根据题中反应原理可知,反应的最后一步是硫与亚硫酸钠反应,反应达到终点时,应是硫与亚硫酸钠恰好完全反应,据此判断反应的现象;
(4)检验产品中是否含有Na2SO3和Na2SO4,由于BaS2O3易溶于水,所以可以向样品的溶液中加入氯化钡,若有沉淀,则有Na2SO3或Na2SO4,再将沉淀过滤、洗涤后,向沉淀中加入稀盐酸,看沉淀能否溶解,若沉淀未完全溶解,并有刺激性气味的气体产生,则说明既有Na2SO3又有Na2SO4,据此答题;
(5)用Na2S和Na2CO3混合溶液代替Na2S和Na2SO3混合溶液可以减小溶液中的硫酸钠的产生;
(6)Na2S2O3溶液与Cl2发生氧化还原反应,生成硫酸根和氯离子,根据电荷守恒和元素守恒书写离子方程式.
解答 解:(1)根据实验流程分析可知,实验最后有二氧化硫或硫化氢等尾气,会污染空气,要用氢氧化钠溶液吸收,所以E中的试剂是NaOH溶液,
故答案为:NaOH溶液;
(2)根据反应Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)、2H2S(aq)+SO2(g)═3S(s)+2H2O(l)、S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)可知,Na2S和Na2SO3反应的总方程式为2Na2S+3SO2+Na2SO3=3Na2S2O3,所以Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)根据题中反应原理可知,反应的最后一步是硫与亚硫酸钠反应,反应达到终点时,应是硫与亚硫酸钠恰好完全反应,此时的现象是溶液变澄清(或浑浊消失),
故答案为:溶液变澄清(或浑浊消失);
(4)检验产品中是否含有Na2SO3和Na2SO4,由于BaS2O3易溶于水,所以可以向样品的溶液中加入氯化钡,若有沉淀,则有Na2SO3或Na2SO4,再将沉淀过滤、洗涤后,向沉淀中加入稀盐酸,看沉淀能否溶解,若沉淀未完全溶解,并有刺激性气味的气体产生,则说明既有Na2SO3又有Na2SO4,
①根据上面的分析可知,步骤II中加入的试剂可以是稀盐酸,故选B;
②步骤II设计过滤操作的目的是分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察,
故答案为:分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察;
(5)用Na2S和Na2CO3混合溶液代替Na2S和Na2SO3混合溶液可以减小溶液中的硫酸钠的产生,所以为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液,
故答案为:先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;
(6)Na2S2O3溶液与Cl2发生氧化还原反应,生成硫酸根和氯离子,反应的离子方程式为S2O32-+4Cl2+5 H2O═2SO42-+8Cl-+10H+,
故答案为:S2O32-+4Cl2+5 H2O═2SO42-+8Cl-+10H+.
点评 本题主要考查物质的制备、性质以及含量的测定,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养,难度较大.

 阳光课堂课时作业系列答案
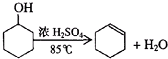
阳光课堂课时作业系列答案 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:
| 密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝回流.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.
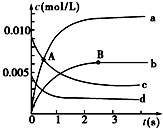 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
| A. | 混合物 | B. | 化合物 | C. | 氧化物 | D. | 有机物 |